Jak zrównoważyć główne hormony odżywianiem. Rytmy dobowe hormonów Wpływ rytmu odżywiania na stan hormonalny
Struktura modułu | Motywy |
Jednostka modułowa 1 | 11.1. Rola hormonów w regulacji metabolizmu 11.2. Mechanizmy przekazywania sygnałów hormonalnych do komórek 11.3. Budowa i synteza hormonów 11.4. Regulacja wymiany podstawowych nośników energii w trakcie prawidłowego rytmu odżywiania 11,5. Zmiany w metabolizmie podczas hipo- i nadmiernego wydzielania hormonów |
Jednostka modułowa 2 | 11.6. Zmiany stanu hormonalnego i metabolizmu podczas postu 11.7. Zmiany stanu hormonalnego i metabolizmu w cukrzycy |
Jednostka modułowa 3 | 11.8. Rozporządzenie metabolizm wody i soli 11.9. Regulacja metabolizmu wapnia i fosforanów. Budowa, synteza i mechanizm działania parathormonu, kalcytriolu i kalcytoniny |
Jednostka modułowa 1 ROLA HORMONÓW W REGULACJI METABOLIZMU. REGULACJA METABOLIZMU WĘGLOWODANÓW, LIPIDÓW, AMINOKWASÓW PODCZAS NORMALNEGO RYTMU ŻYWIENIA
Cele nauczania Być w stanie:
1. Wykorzystać wiedzę o molekularnych mechanizmach regulacji metabolizmu i funkcji organizmu do zrozumienia biochemicznych podstaw homeostazy i adaptacji.
2. Wykorzystywać wiedzę o mechanizmach działania hormonów (insuliny i hormonów przeciwwyspowych: glukagonu, kortyzolu, adrenaliny, somatotropiny, jodotyroniny) do charakteryzowania zmian w metabolizmie energetycznym przy zmianie okresów trawienia i stanu poabsorpcyjnego.
3. Analizować zmiany metaboliczne podczas hipo- i hiperprodukcji kortyzolu i hormonu wzrostu, choroby i zespołu Cushinga (akromegalii) oraz nadczynności i niedoczynności Tarczyca(wole toksyczne rozsiane, wole endemiczne).
Wiedzieć:
1. Współczesne nazewnictwo i klasyfikacja hormonów.
2. Główne etapy przekazywania sygnałów hormonalnych do komórki.
3. Etapy syntezy i wydzielania insuliny i głównych hormonów przeciwwyrostkowych.
4. Mechanizmy utrzymania stężenia głównych nośników energii we krwi
cielęta o normalnym rytmie karmienia.
Temat 11.1. ROLA GOMONÓW W REGULACJI METABOLIZMU
1. Do normalnego funkcjonowania organizm wielokomórkowy Niezbędna jest interakcja pomiędzy poszczególnymi komórkami, tkankami i narządami. Związek ten realizowany jest poprzez:
system nerwowy(centralny i obwodowy) poprzez impulsy nerwowe i neuroprzekaźniki;
układ hormonalny poprzez gruczoły dokrewne i hormony, które są syntetyzowane przez wyspecjalizowane komórki tych gruczołów, są uwalniane do krwi i transportowane do różnych narządów i tkanek;
parakrynny I autokrynny za pośrednictwem różnych związków wydzielanych do przestrzeni międzykomórkowej i oddziałujących z receptorami pobliskich komórek lub tej samej komórki (prostaglandyny, hormony przewód pokarmowy, histamina itp.);
układ odpornościowy poprzez specyficzne białka (cytokiny, przeciwciała).
2. Układ hormonalny zapewnia regulację i integrację metabolizmu w różnych tkankach w odpowiedzi na zmiany zewnętrzne i środowisko wewnętrzne. Hormony działają jako przekaźniki chemiczne, które przekazują informacje o tych zmianach do różnych narządów i tkanek. Odpowiedź komórki na działanie hormonu jest zdeterminowana zarówno budową chemiczną hormonu, jak i rodzajem komórki, na którą skierowane jest jego działanie. Hormony występują we krwi w bardzo małych stężeniach, a ich działanie jest zwykle krótkotrwałe.
Wynika to po pierwsze z regulacji ich syntezy i wydzielania, a po drugie z wysokiego stopnia inaktywacji krążących hormonów. Główne połączenia między układami regulacyjnymi nerwowymi i hormonalnymi realizowane są za pomocą specjalnych części mózgu - podwzgórza i przysadki mózgowej. System regulacji neurohumoralnej ma swoją własną hierarchię, którego szczytem jest centralny układ nerwowy i ścisła sekwencja procesów.
3. Hierarchia systemów regulacyjnych. Systemy regulujące metabolizm i funkcje organizmu tworzą trzy hierarchiczne poziomy (ryc. 11.1).
Pierwszy poziom- ośrodkowy układ nerwowy. Komórki nerwowe odbierają sygnały pochodzące ze środowiska zewnętrznego i wewnętrznego, przekształcają je w postać impulsu nerwowego, który na synapsie powoduje uwolnienie przekaźnika. Mediatory powodują zmiany metaboliczne w komórkach efektorowych poprzez wewnątrzkomórkowe mechanizmy regulacyjne.
Drugi poziom- układ hormonalny- obejmuje podwzgórze, przysadkę mózgową, obwodowe gruczoły wydzielania wewnętrznego, a także wyspecjalizowane komórki niektórych narządów i tkanek (przewód pokarmowy, adipocyty), które syntetyzują hormony i uwalniają je do krwi pod wpływem odpowiedniego bodźca.
Trzeci poziom- wewnątrzkomórkowy- stanowią zmiany w metabolizmie wewnątrz komórki lub na odrębnym szlaku metabolicznym, które powstają w wyniku:
Zmiany działalność enzymy poprzez aktywację lub inhibicję;
Zmiany wielkie ilości enzymy poprzez mechanizm indukcji lub tłumienia syntezy białek lub zmiany szybkości ich degradacji;
Zmiany prędkość transportu substancji przez błony komórkowe. Synteza I wydzielanie hormonu stymulowane przez czynniki zewnętrzne i wewnętrzne
sygnały dostające się do centralnego układu nerwowego. Te sygnały połączenia nerwowe dostają się do podwzgórza, gdzie stymulują syntezę hormony peptydowe(tzw. hormony uwalniające) – liberyny i statyny. Liberyjczycy I statyny transportowane do przedniego płata przysadki mózgowej, gdzie stymulują lub hamują syntezę hormonów tropowych. Hormony tropowe przysadki mózgowej stymulują syntezę i wydzielanie hormonów obwodowych gruczoły wydzielania wewnętrznego które dostają się do ogólnego krwioobiegu. Niektóre hormony podwzgórza gromadzą się w tylnym płacie przysadki mózgowej, skąd są wydzielane do krwi (wazopresyna, oksytocyna).
 Zmiany stężenia metabolitów w komórkach docelowych zgodnie z mechanizmem negatywnym informacja zwrotna hamuje syntezę hormonów, działając na gruczoły dokrewne lub na podwzgórze; synteza i wydzielanie hormonów tropowych jest hamowana przez hormony gruczołów obwodowych.
Zmiany stężenia metabolitów w komórkach docelowych zgodnie z mechanizmem negatywnym informacja zwrotna hamuje syntezę hormonów, działając na gruczoły dokrewne lub na podwzgórze; synteza i wydzielanie hormonów tropowych jest hamowana przez hormony gruczołów obwodowych.
TEMAT 11.2. MECHANIZMY PRZEKAZYWANIA SYGNAŁÓW HORMONALNYCH DO KOMÓREK
Biologiczne działanie hormonów objawia się poprzez ich interakcję z komórkami posiadającymi receptory dla tego hormonu (komórki docelowe). Dla manifestacji aktywność biologiczna Związanie hormonu z receptorem musi skutkować powstaniem w komórce sygnału chemicznego, który wywołuje specyficzną odpowiedź biologiczną, taką jak zmiana szybkości syntezy enzymów i innych białek lub zmiana ich aktywności (patrz Moduł 4). Celem dla hormonu mogą być komórki jednej lub większej liczby tkanek. Działając na komórkę docelową, hormon wywołuje specyficzną reakcję, której przejaw zależy od tego, które szlaki metaboliczne są w tej komórce aktywowane, a które hamowane. Przykładowo tarczyca jest specyficznym celem dla tyreotropiny, pod wpływem której zwiększa się liczba komórek groniastych tarczycy i wzrasta tempo biosyntezy hormonów tarczycy. Glukagon działając na adipocyty, aktywuje lipolizę oraz stymuluje mobilizację glikogenu i glukoneogenezę w wątrobie.
Receptory Hormony mogą znajdować się w błonie komórkowej lub wewnątrz komórki (w cytozolu lub jądrze).
Według mechanizmu działania Hormony można podzielić na dwie grupy:
DO Pierwszy grupa obejmuje hormony, z którymi wchodzą w interakcje receptory błonowe(hormony peptydowe, adrenalina, a także hormony akcja lokalna- cytokiny, eikozanoidy);
- drugi grupa obejmuje hormony, z którymi wchodzą w interakcje receptory wewnątrzkomórkowe- hormony steroidowe, tyroksyna (patrz moduł 4).
Wiązanie hormonu (głównego przekaźnika) z receptorem prowadzi do zmiany konformacji receptora. Zmiany te są wychwytywane przez inne makrocząsteczki, tj. wiązanie hormonu z receptorem prowadzi do parowania niektórych cząsteczek z innymi (przekazywanie sygnału). W ten sposób generowany jest sygnał regulujący odpowiedź komórkową. W zależności od sposobu przekazywania sygnału hormonalnego zmienia się tempo reakcji metabolicznych w komórkach:
W wyniku zmian w aktywności enzymatycznej;
W wyniku zmian liczby enzymów (ryc. 11.2).
 Ryż. 11.2. Główne etapy przekazywania sygnału hormonalnego do komórek docelowych
Ryż. 11.2. Główne etapy przekazywania sygnału hormonalnego do komórek docelowych
TEMAT 11.3. STRUKTURA I BIOSYNTEZA HORMONÓW
1. Hormony peptydowe powstają, podobnie jak inne białka, podczas translacji z aminokwasów. Niektóre hormony peptydowe są krótkimi peptydami; na przykład hormon podwzgórza tyreotropina - liberyna - tripeptyd. Większość hormonów przedniego płata przysadki mózgowej to glikoproteiny.
Niektóre hormony peptydowe są produktami wspólny gen(ryc. 11.3). Większość hormonów polipeptydowych syntetyzowana jest w postaci nieaktywnych prekursorów – preprohormonów. Tworzenie aktywnych hormonów następuje w wyniku częściowej proteolizy.
2. Insulina- polipeptyd składający się z dwóch łańcuchów polipeptydowych. Łańcuch A zawiera 21 reszt aminokwasowych, łańcuch B zawiera 30 reszt aminokwasowych. Obydwa łańcuchy są połączone dwoma mostkami dwusiarczkowymi. Cząsteczka insuliny zawiera także wewnątrzcząsteczkowy mostek dwusiarczkowy w łańcuchu A.
Biosynteza insuliny rozpoczyna się od powstania nieaktywnych prekursorów, preproinsuliny i proinsuliny, które w wyniku sekwencyjnej proteolizy przekształcają się w aktywny hormon. Biosynteza preproinsuliny rozpoczyna się od utworzenia peptydu sygnałowego na polirybosomach związanych z siateczką śródplazmatyczną. Sygnał
 Ryż. 11.3. Tworzenie hormonów peptydowych, które są produktami wspólnego genu:
Ryż. 11.3. Tworzenie hormonów peptydowych, które są produktami wspólnego genu:
A - POMC (proopiomelanokortyna) jest syntetyzowana w przednich i pośrednich płatach przysadki mózgowej oraz w niektórych innych tkankach (jelita, łożysko). Łańcuch polipeptydowy składa się z 265 reszt aminokwasowych; B - po rozszczepieniu N-końcowego peptydu sygnałowego, łańcuch polipeptydowy zostaje rozszczepiony na dwa fragmenty: ACTH (39 aa) i β-lipotropina (42-134 aa); C, D, E - w wyniku dalszej proteolizy powstają α- i β-MSH (hormon stymulujący melanocyty) oraz endorfiny. CPPDG jest hormonem podobnym do kortykotropiny, działającym w płacie pośrednim przysadki mózgowej. Przetwarzanie POMC w przednich i pośrednich płatach przysadki mózgowej przebiega w różny sposób, z utworzeniem innego zestawu peptydów
peptyd przenika do światła siateczki śródplazmatycznej i kieruje rosnący łańcuch polipeptydowy do ER. Po zakończeniu syntezy preproinsuliny peptyd sygnałowy zostaje odszczepiony (ryc. 11.4).
Proinsulina (86 reszt aminokwasowych) trafia do aparatu Golgiego, gdzie pod działaniem specyficznych proteaz ulega rozszczepieniu w kilku obszarach tworząc insulinę (51 reszt aminokwasowych) i peptyd C, składający się z 31 reszt aminokwasowych. Insulina i peptyd C w ilościach równomolowych wchodzą w skład granulek wydzielniczych. W granulkach insulina łączy się z cynkiem, tworząc dimery i heksamery. Dojrzałe granulki łączą się z błoną komórkową, a insulina i peptyd C są wydzielane do płynu pozakomórkowego w wyniku egzocytozy. Po wydzieleniu do krwi oligomery insuliny rozpadają się. Okres półtrwania insuliny w osoczu krwi wynosi 3-10 minut, peptydu C - około 30 minut. Degradacja insuliny następuje pod wpływem enzymu insulinazy głównie w wątrobie iw mniejszym stopniu w nerkach.
Głównym stymulatorem syntezy i wydzielania insuliny jest glukoza. Wydzielanie insuliny wzmagają także niektóre aminokwasy (zwłaszcza arginina i lizyna), ciała ketonowe i kwasy tłuszczowe. Adrenalina, somatostatyna i niektóre peptydy żołądkowo-jelitowe hamują wydzielanie insuliny.
 Ryż. 11.4. Schemat biosyntezy insuliny w komórkach trzustki:
Ryż. 11.4. Schemat biosyntezy insuliny w komórkach trzustki:
1 - synteza łańcucha polipeptydowego proinsuliny; 2 - synteza zachodzi na polirybosomach przyczepionych do zewnętrznej powierzchni błony ER; 3 - peptyd sygnałowy zostaje odszczepiony po zakończeniu syntezy łańcucha polipeptydowego i powstaje proinsulina; 4 - proinsulina jest transportowana z ER do aparatu Golgiego i rozkładana na insulinę i peptyd C; 5 - insulina i peptyd C wchodzą w skład ziarnistości wydzielniczych i są uwalniane w procesie egzocytozy (6); ER - siateczka śródplazmatyczna; N - końcowa część cząsteczki;
3. Glukagon- polipeptyd jednołańcuchowy składający się z 29 reszt aminokwasowych. Biosynteza glukagonu zachodzi w komórkach α wysepek Langerhansa z nieaktywnego prekursora preproglukagonu, który w wyniku częściowej proteolizy przekształca się w aktywny hormon. Glukoza i insulina hamują wydzielanie glukagonu; stymuluje ją wiele związków, w tym aminokwasy, kwasy tłuszczowe i neuroprzekaźniki (adrenalina). Okres półtrwania hormonu wynosi ~ 5 minut. W wątrobie glukagon jest szybko niszczony przez specyficzne proteazy.
4. Somatotropina syntetyzowany jako prohormon w komórkach somatotroficznych, których najliczniej jest w przednim płacie przysadki mózgowej. Hormon wzrostu u wszystkich gatunków ssaków ma pojedynczy łańcuch
peptyd kontrolny o masie cząsteczkowej 22 kDa, składający się ze 191 reszt aminokwasowych i posiadający dwa wewnątrzcząsteczkowe wiązania disiarczkowe. Wydzielanie hormonu wzrostu pulsuje w odstępach 20-30 minut. Jeden z największych szczytów występuje wkrótce po zaśnięciu. Pod wpływem różnych bodźców (np. ćwiczenia fizyczne, post, pokarmy białkowe, aminokwas arginina) nawet u nierosnących dorosłych poziom hormonu wzrostu we krwi może wzrosnąć do 30-100 ng/ml. Regulacja syntezy i wydzielania hormonu wzrostu odbywa się za pomocą wielu czynników. Główne działanie stymulujące wywiera somatoliberyna, głównym działaniem hamującym jest podwzgórzowa somatostatyna.
5. Jodotyroniny syntetyzowany jako część białka - tyreoglobuliny (Tg)
 Ryż. 11,5. Synteza jodotyronin:
Ryż. 11,5. Synteza jodotyronin:
ER - siateczka śródplazmatyczna; DIT – dijodotyronina; Tg - tyreoglobulina; T 3 - trójjodotyronina, T 4 - tyroksyna. Tyreoglobulina syntetyzowana jest na rybosomach, następnie wchodzi do kompleksu Golgiego, a następnie do koloidu zewnątrzkomórkowego, gdzie jest magazynowana i gdzie następuje jodowanie reszt tyrozyny. Tworzenie jodotyronin przebiega w kilku etapach: transport jodu do komórek tarczycy, utlenianie jodu, jodowanie reszt tyrozyny, tworzenie jodotyronin, transport jodotyroniny do krwi
Tyreoglobulina- glikoproteina zawierająca 115 reszt tyrozynowych, syntetyzowana w podstawnej części komórki i magazynowana w koloidie zewnątrzkomórkowym, gdzie następuje jodowanie reszt tyrozynowych i tworzenie jodotyronin.
Pod wpływem peroksydaza tarczycowa utleniony jod reaguje z resztami tyrozyny, tworząc monojodotyroniny (MIT) i dijodotyroniny (DIT). Dwie cząsteczki DIT kondensują, tworząc T4, a MIT i DIT kondensują, tworząc T3. Jodotyreoglobulina jest transportowana do komórki na drodze endocytozy i hydrolizowana przez enzymy lizosomalne w celu uwolnienia T3 i T4 (ryc. 11.6).
 Ryż. 11.6. Budowa hormonów tarczycy
Ryż. 11.6. Budowa hormonów tarczycy
T3 jest główną biologicznie aktywną formą jodotyroniny; jego powinowactwo do receptora komórki docelowej jest 10 razy większe niż w przypadku T4. W tkankach obwodowych w wyniku odjodowania części T 4 przy piątym atomie węgla powstaje tzw. „Odwrotna” forma T 3, która jest prawie całkowicie pozbawiona aktywności biologicznej
We krwi jodotyroniny występują w postaci związanej w kompleksie z białkiem wiążącym tyroksynę. Tylko 0,03% T4 i 0,3% T3 jest w stanie wolnym. Aktywność biologiczna jodotyroniny wynika z obecności frakcji niezwiązanej. Białka transportowe pełnią funkcję swego rodzaju magazynu, który może dostarczyć dodatkowych ilości wolnych hormonów. Synteza i wydzielanie jodotyroniny regulowane są przez układ podwzgórzowo-przysadkowy
 Ryż. 11.7. Regulacja syntezy i wydzielania jodotyronin:
Ryż. 11.7. Regulacja syntezy i wydzielania jodotyronin:
1 - tyreotropina-liberyna stymuluje uwalnianie TSH; 2 - TSH stymuluje syntezę i wydzielanie jodotyroniny; 3,4 - jodotyroniny hamują syntezę i wydzielanie TSH
Jodotyroniny regulują dwa rodzaje procesów:
Wzrost i różnicowanie tkanek;
Wymiana energii.
6. Kortykosteroidy. Wspólnym prekursorem wszystkich kortykosteroidów jest cholesterol. Źródłem cholesterolu do syntezy kortykosteroidów są jego estry, które dostają się do komórki jako część LDL lub odkładają się w komórce. Kortykotropina stymuluje uwalnianie cholesterolu z jego estrów i syntezę kortykosteroidów. Reakcje syntezy kortyzolu zachodzą w różnych przedziałach komórek kory nadnerczy (patrz ryc. 11.12). Podczas syntezy kortykosteroidów powstaje ponad 40 metabolitów różniących się budową i aktywnością biologiczną. Głównymi kortykosteroidami o wyraźnej aktywności hormonalnej są kortyzol - główny przedstawiciel grupy glukokortykoidów, aldosteron - główny mineralokortykoid i androgeny.
Na pierwszym etapie syntezy kortykosteroidów cholesterol przekształca się w pregnenolon poprzez odszczepienie 6-węglowego fragmentu z bocznego łańcucha cholesterolu i utlenienie atomu węgla C20. Pregnenolon przekształca się w progesteron – steroidy prekursorowe C21 – kortyzol i aldosteron – oraz steroidy C19 – prekursory androgenów. To, jakim sterydem okaże się produkt końcowy, zależy od zestawu enzymów w komórce i kolejności reakcji hydroksylacji (ryc. 11.8).
 Ryż. 11.8. Synteza głównych kortykosteroidów:
Ryż. 11.8. Synteza głównych kortykosteroidów:
1 - konwersja cholesterolu do pregnenolonu; 2 - tworzenie progesteronu;
3-hydroksylacja progesteronu (17-21-11) i powstawanie kortyzolu;
4 - hydroksylacja progesteronu (21-11) i tworzenie aldosteronu;
5 - szlak syntezy androgenów
Pierwotna hydroksylacja progesteronu przez 17-hydroksylazę, a następnie przez 21- i 11-hydroksylazę prowadzi do syntezy kortyzolu. Reakcje powstawania aldosteronu obejmują hydroksylację progesteronu najpierw przez 21-hydroksylazę, a następnie 11-hydroksylazę (patrz ryc. 11.8). Tempo syntezy i wydzielania kortyzolu regulowane jest przez układ podwzgórzowo-przysadkowy poprzez mechanizm ujemnego sprzężenia zwrotnego (ryc. 11.9).
Hormony steroidowe są transportowane we krwi w połączeniu ze specyficznymi białkami transportowymi.
Katabolizm wydzielanie hormonów nadnerczy zachodzi głównie w wątrobie. Tutaj zachodzą reakcje hydroksylacji, utleniania i
 Ryż. 11.9. Regulacja syntezy i wydzielania kortyzolu:
Ryż. 11.9. Regulacja syntezy i wydzielania kortyzolu:
1 - stymulacja syntezy kortykotropiny-liberyny; 2 - liberina kortykotropina stymuluje syntezę i wydzielanie ACTH; 3 - ACTH stymuluje syntezę i wydzielanie kortyzolu; 4 – kortyzol hamuje wydzielanie ACTH i kortykoliberyny
przywrócenie hormonów. Produkty katabolizmu kortykosteroidów (z wyjątkiem kortykosteronu i aldosteronu) są wydalane z moczem w postaci 17-ketosteroidy. Te produkty przemiany materii są wydalane głównie w postaci koniugatów z kwasami glukuronowymi i siarkowymi. U mężczyzn 2/3 ketosteroidów tworzą kortykosteroidy, a 1/3 testosteron (w sumie 12-17 mg na dzień). U kobiet 17-ketosteroidy powstają głównie z powodu kortykosteroidów (7-12 mg na dzień).
TEMAT 11.4. REGULACJA WYMIANY GŁÓWNYCH NOŚNIKÓW ENERGII W NORMALNYM RYTMIE
ŻYWNOŚĆ
1. Wartość energetyczna podstawowych składników pokarmowych wyrażana jest w kilokaloriach i wynosi: dla węglowodanów – 4 kcal/g, dla tłuszczów – 9 kcal/g, dla białek – 4 kcal/g. Zdrowy dorosły potrzebuje 2000-3000 kcal (8000-12 000 kJ) energii dziennie.
Przy normalnej diecie przerwy między posiłkami wynoszą 4-5 godzin z 8-12-godzinną przerwą nocną. Podczas trawienia i okres wchłaniania(2-4 godziny) główne nośniki energii wykorzystywane przez tkanki (glukoza, kwasy tłuszczowe, aminokwasy) mogą przedostać się do krwi bezpośrednio z przewodu pokarmowego. W okres poabsorpcyjny(okres czasu od zakończenia trawienia do następne spotkanie pożywieniem), a podczas postu powstają substraty energetyczne
w procesie katabolizmu zdeponowanych nośników energii. Główną rolę w regulacji tych procesów odgrywają insulina I glukagon. Antagoniści insuliny też są adrenalina, kortyzol, jodotyronina i somatotropina
(tzw. hormony przeciwwyspowe).
Insulina i hormony przeciwwyspowe zapewniają równowagę pomiędzy potrzebami i możliwościami organizmu w zakresie pozyskiwania energii niezbędnej do prawidłowego funkcjonowania i wzrostu. Saldo to definiuje się jako homeostaza energetyczna. Przy prawidłowym rytmie karmienia stężenie glukozy we krwi utrzymuje się na poziomie 65-110 mg/dl (3,58-6,05 mmol/l) dzięki działaniu dwóch głównych hormonów - insuliny i glukagonu. Insulina i glukagon są głównymi regulatorami metabolizmu podczas zmiany stanów trawienia, okresu poabsorpcyjnego i postu. Okresy trawienia trwają 10-15 godzin dziennie, a zużycie energii następuje w ciągu 24 godzin. Dlatego część nośników energii podczas trawienia jest magazynowana do wykorzystania w okresie poabsorpcyjnym.
Wątroba, tkanka tłuszczowa i mięśnie to główne narządy zapewniające przemiany metaboliczne zgodne z rytmem odżywiania. Tryb przechowywania włącza się po jedzeniu i zastępuje tryb mobilizacji rezerw po zakończeniu okresu wchłaniania.
2. Zmiany metabolizmu głównych nośników energii w okresie absorpcji głównie ze względu na wysoką insulina-glukagon indeks
(ryc. 11.10).
W wątrobie wzrasta zużycie glukozy, co jest konsekwencją przyspieszenia szlaków metabolicznych, w których glukoza przekształcana jest w zmagazynowane formy nośników energii: glikogen I tłuszcze.
Gdy wzrasta stężenie glukozy w hepatocytach, aktywowana jest glukokinaza, przekształcająca glukozę w glukozo-6-fosforan. Ponadto insulina indukuje syntezę mRNA glukokinazy. W rezultacie wzrasta stężenie glukozo-6-fosforanu w hepatocytach, co powoduje przyspieszenie synteza glikogenu. Sprzyja temu także jednoczesna inaktywacja fosforylazy glikogenu i aktywacja syntazy glikogenu. Pod wpływem insuliny w hepatocytach Glikoliza przyspiesza w wyniku zwiększonej aktywności i ilości kluczowych enzymów: glukokinazy, fosfofruktokinazy i kinazy pirogronianowej. Jednocześnie glukoneogeneza zostaje zahamowana w wyniku inaktywacji fruktozo-1,6-bisfosfatazy i insulinowej represji syntezy karboksykinazy fosfoenolopirogronianowej, kluczowych enzymów glukoneogenezy (patrz moduł 6).
Wzrost stężenia glukozo-6-fosforanu w hepatocytach w okresie wchłaniania łączy się z aktywnym wykorzystaniem NADPH do syntezy Kwasy tłuszczowe co pomaga stymulować szlak pentozofosforanowy.
Przyspieszenie syntezy kwasów tłuszczowych zapewnia dostępność substratów (acetylo-CoA i NADPH) powstających podczas metabolizmu glukozy, a także aktywacja i indukcja enzymów kluczowych do syntezy kwasów tłuszczowych przez insulinę.
 Ryż. 11.10. Sposoby wykorzystania głównych nośników energii w okresie absorpcji:
Ryż. 11.10. Sposoby wykorzystania głównych nośników energii w okresie absorpcji:
1 - biosynteza glikogenu w wątrobie; 2 - glikoliza; 3 - biosynteza TAG w wątrobie; 4 - Biosynteza TAG w tkance tłuszczowej; 5 - biosynteza glikogenu w mięśniach; 6 - biosynteza białek w różnych tkankach, w tym w wątrobie; FA – kwasy tłuszczowe
Aminokwasy dostające się do wątroby z przewodu pokarmowego wykorzystywane są do syntezy białek i innych związków zawierających azot, a ich nadmiar albo przedostaje się do krwi i jest transportowany do innych tkanek, albo ulega deaminacji z późniejszym włączeniem reszt bezazotowych do organizmu. wspólna ścieżka katabolizm (patrz moduł 9).
Zmiany metabolizmu w adipocytach. Główną funkcją tkanki tłuszczowej jest magazynowanie nośników energii w postaci triacyloglicerole. transport glukozy w adipocyty. Wzrost wewnątrzkomórkowego stężenia glukozy i aktywacja kluczowych enzymów glikolitycznych zapewniają powstawanie acetylo-CoA i gliceryno-3-fosforanu, niezbędnych do syntezy TAG. Stymulacja szlaku pentozofosforanowego zapewnia powstawanie NADPH, niezbędnego do syntezy kwasów tłuszczowych. Jednakże biosynteza kwasów tłuszczowych de novo w ludzkiej tkance tłuszczowej zachodzi z dużą szybkością dopiero po wcześniejszym poszczeniu. Podczas normalnego rytmu odżywiania synteza TAG wykorzystuje głównie kwasy tłuszczowe pochodzące z chylomikronów i VLDL pod działaniem lipazy LP (patrz moduł 8).
Ponieważ wrażliwa na hormony lipaza TAG w stanie absorpcyjnym występuje w formie defosforylowanej, nieaktywnej, proces lipolizy jest hamowany.
Zmiany w metabolizmie mięśni. Przyspiesza pod wpływem insuliny transport glukozy w komórki tkanka mięśniowa. Glukoza ulega fosforylacji i utlenianiu, aby zapewnić komórkom energię, a także jest wykorzystywana do syntezy glikogenu. Kwasy tłuszczowe pochodzące z chylomikronów i VLDL odgrywają w tym okresie niewielką rolę w metabolizmie energetycznym mięśni. Pod wpływem insuliny zwiększa się także przepływ aminokwasów do mięśni i biosynteza białek, szczególnie po spożyciu pokarmów białkowych i podczas pracy mięśni.
3. Zmiany w metabolizmie głównych nośników energii przy przejściu ze stanu absorpcyjnego do stanu poabsorpcyjnego. W okresie poabsorpcyjnym, wraz ze spadkiem indeksu insulinowo-glukagonowego, zmiany metaboliczne mają na celu głównie utrzymanie stężenia glukozy we krwi, która stanowi główny substrat energetyczny dla mózgu i jedyne źródło energii dla czerwonych krwinek. krwinki. Główne zmiany metaboliczne w tym okresie zachodzą w wątrobie i tkance tłuszczowej (ryc. 11.11) i mają na celu uzupełnienie wewnętrznych zapasów glukozy oraz wykorzystanie innych substratów energetycznych (tłuszczów i aminokwasów).
Zmiany w metabolizmie wątroby. Przyspiesza pod wpływem glukagonu mobilizacja glikogenu(patrz Moduł 6). Zapasy glikogenu w wątrobie wyczerpują się podczas 18-24-godzinnego postu. Gdy zapasy glikogenu się wyczerpią, głównym źródłem glukozy staje się glukoneogeneza, który zaczyna przyspieszać 4-6 godzin po ostatnim posiłku. Substratami do syntezy glukozy są mleczan, glicerol I aminokwasy. Szybkość syntezy kwasów tłuszczowych zmniejsza się w wyniku fosforylacji i inaktywacji karboksylazy acetylo-CoA podczas fosforylacji, a zwiększa się szybkość β-oksydacji. Jednocześnie zwiększa się dopływ do wątroby kwasów tłuszczowych, które w wyniku przyspieszonej lipolizy są transportowane ze złogów tłuszczu. Acetylo-CoA, powstający w wyniku utleniania kwasów tłuszczowych, wykorzystywany jest w wątrobie synteza ciał ketonowych.
W tkance tłuszczowej z zmniejsza się tempo syntezy TAG i następuje stymulacja lipolizy. Pobudzenie lipolizy następuje na skutek aktywacji hormonowrażliwej lipazy TAG adipocytów pod wpływem glukagonu. Kwasy tłuszczowe stają się ważnym źródłem energii w wątrobie, mięśniach i tkance tłuszczowej.
Tym samym w okresie poabsorpcyjnym stężenie glukozy we krwi utrzymuje się na poziomie 60-100 mg/dl (3,5-5,5 mmol/l), wzrasta natomiast poziom kwasów tłuszczowych i ciał ketonowych.
 Ryż. 11.11. Sposoby wykorzystania głównych nośników energii przy zmianie stanu absorpcyjnego na poabsorpcyjny:
Ryż. 11.11. Sposoby wykorzystania głównych nośników energii przy zmianie stanu absorpcyjnego na poabsorpcyjny:
I - spadek wskaźnika insulinowo-glukagonowego; 2 - rozkład glikogenu; 3, 4 - transport glukozy do mózgu i erytrocytów; 5 - katabolizm tłuszczów; 6 - transport tłuszczów do wątroby i mięśni; 7 - synteza ciał ketonowych w wątrobie; 8 - transport ciał ketonowych do mięśni; 9 - glukoneogeneza z aminokwasów; 10 - synteza i wydalanie mocznika;
II - transport mleczanu do wątroby i udział w glukoneogenezie; 12 - glukoneogeneza z glicerolu; KT – ciała ketonowe; FA – kwasy tłuszczowe
TEMAT 11.5. ZMIANY METABOLIZMU PODCZAS HIPO- I HIPERSEKRECJI HORMONÓW
Zmiana szybkości syntezy i wydzielania hormonów może nastąpić nie tylko jako proces adaptacyjny, który następuje w odpowiedzi na zmiany w aktywności fizjologicznej organizmu, ale często jest wynikiem zaburzeń czynności czynnościowej gruczołów dokrewnych w okresie dojrzewania. rozwój procesów patologicznych lub rozregulowanie w nich. Zaburzenia te mogą objawiać się w formie niedoczynność, prowadząc do zmniejszenia ilości hormonu, lub nadczynność, towarzyszy jej nadmierna synteza.
1. Nadczynność tarczycy(nadczynność tarczycy) objawia się kilkoma postaciami klinicznymi. Wole toksyczne rozproszone(choroba Gravesa-Basedowa, choroba Gravesa-Basedowa) jest najczęstszą chorobą tarczycy. W przypadku tej choroby następuje wzrost wielkości tarczycy (wola), wzrost stężenia jodotyroniny 2-5 razy i rozwój tyreotoksykozy.
Charakterystycznymi objawami tyreotoksykozy są: zwiększenie podstawowej przemiany materii, przyspieszenie akcji serca, słabe mięśnie, utrata masy ciała (pomimo zwiększonego apetytu), pocenie się, podwyższona temperatura ciała, drżenie i wytrzeszcz (wyłupiaste oczy). Objawy te odzwierciedlają równoczesną stymulację przez jodotyroniny zarówno procesów anabolicznych (wzrost i różnicowanie tkanek), jak i katabolicznych (katabolizm węglowodanów, lipidów i białek). W większym stopniu nasilają się procesy kataboliczne, o czym świadczy ujemny bilans azotowy. Nadczynność tarczycy może wystąpić z różnych przyczyn: rozwoju nowotworu, zapalenia (tarczycy), nadmiernego spożycia jodu i leków zawierających jod, reakcji autoimmunologicznych.
Nadczynność tarczycy autoimmunologiczna powstaje w wyniku tworzenia się przeciwciał przeciwko receptorom hormonu tyreotropowego w gruczole tarczowym. Jedna z nich, immunoglobulina (IgG), imituje działanie tyreotropiny poprzez oddziaływanie z receptorami TSH na błonie komórek tarczycy. Prowadzi to do rozproszonej proliferacji tarczycy i nadmiernej, niekontrolowanej produkcji T3 i T4, ponieważ powstawanie IgG nie jest regulowane przez mechanizm sprzężenia zwrotnego. Poziom TSH w tej chorobie jest obniżony na skutek zahamowania czynności przysadki mózgowej przez wysokie stężenia jodotyroniny.
2. Niedoczynność tarczycy może być skutkiem niedostatecznego spożycia jodu w organizmie – wole endemiczne. Rzadziej niedoczynność tarczycy występuje w wyniku wrodzonych defektów enzymów biorących udział w syntezie (na przykład peroksyrazy tarczycowej) jodotyroniny lub jako powikłanie innych chorób uszkadzających podwzgórze, przysadkę mózgową lub tarczycę. W niektórych postaciach niedoczynności tarczycy we krwi wykrywane są przeciwciała przeciwko tyreoglobulinie. Niedoczynność tarczycy we wczesnym dzieciństwie prowadzi do opóźnienia rozwoju fizycznego i psychicznego - kretynizm. U dorosłych niedoczynność objawia się jako obrzęk śluzowy(obrzęk śluzu). Głównym objawem obrzęku śluzowatego jest nadmierne gromadzenie się proteoglikanów i wody w skórze. Główne objawy niedoczynności tarczycy: senność, obniżona tolerancja na zimno, przyrost masy ciała, obniżona temperatura ciała.
3. Hiperkortyka. Nadmierna produkcja kortykosteroidów, głównie kortyzolu, - hiperkortyzolemia- często wynika z zakłócenia mechanizmów regulacyjnych syntezy kortyzolu:
Z guzem przysadki mózgowej i zwiększoną produkcją kortykotropiny (choroba Itsenki-Cushinga);
W przypadku guzów nadnerczy wytwarzających kortyzol (zespół Itsenki-Cushinga).
Główne objawy hiperkortyzolizmu: hiperglukozemia i zmniejszona tolerancja glukozy na skutek stymulacji glukoneogenezy oraz nadciśnienie w wyniku ujawnienia się mineralokortykoidowego działania kortyzolu i zwiększonego stężenia jonów Na+.
4. Niedoczynność kory mózgowej. Dziedziczna dystrofia nadnerczowo-płciowa w 95% przypadków jest to konsekwencja niedoboru 21-hydroksylazy (patrz ryc. 11.8). Jednocześnie wzrasta powstawanie 17-OH progesteronu i produkcja androgenów. Charakterystyczne objawy chorobami są wczesne dojrzewanie u chłopców i rozwój męskich cech płciowych u dziewcząt. Przy częściowym niedoborze 21-hydroksylazy u kobiet cykl menstruacyjny może zostać zakłócony.
Nabyta niewydolność nadnerczy może rozwinąć się w wyniku gruźliczego lub autoimmunologicznego uszkodzenia komórek kory nadnerczy i zmniejszonej syntezy kortykosteroidów. Utrata kontroli regulacyjnej nadnerczy prowadzi do zwiększonego wydzielania kortykotropiny. W takich przypadkach u pacjentów występuje zwiększona pigmentacja skóry i błon śluzowych (choroba Addisona), co wynika ze zwiększonej produkcji kortykotropiny i innych pochodnych POMC, w szczególności hormonu stymulującego melanocyty (patrz ryc. 11.3). Główne objawy kliniczne niewydolności nadnerczy: niedociśnienie, osłabienie mięśni, hiponatremia, utrata masy ciała, nietolerancja stresu.
Niewydolność kory nadnerczy często wynika z długotrwałego stosowania leków kortykosteroidowych, które hamują syntezę kortykotropiny poprzez mechanizm sprzężenia zwrotnego. Brak sygnałów stymulujących prowadzi do atrofii komórek kory nadnerczy. W przypadku nagłego odstawienia leków hormonalnych może rozwinąć się ostra niewydolność nadnerczy (tzw. zespół odstawienia), która stanowi ogromne zagrożenie dla życia, gdyż towarzyszy jej dekompensacja wszystkich typów procesów metabolicznych i adaptacyjnych. Objawia się zapadnięciem się naczyń, ciężką adynamią i utratą przytomności. Stan ten występuje z powodu naruszenia metabolizmu elektrolitów, co prowadzi do utraty jonów Na+ i C1 - w moczu oraz odwodnienia z powodu utraty płynu pozakomórkowego. Zmiany w metabolizmie węglowodanów objawiają się spadkiem poziomu cukru we krwi, zmniejszeniem rezerw glikogenu w wątrobie i mięśniach szkieletowych.
1. Przenieś go do zeszytu i uzupełnij tabelę. 11.1.
Tabela 11.1. Insulina i główne hormony przeciwstawne
2. Korzystając z rys. 11.4, zapisz etapy syntezy insuliny. Wyjaśnij, jakie przyczyny mogą prowadzić do rozwoju niedoboru insuliny? Dlaczego w takich przypadkach możliwe jest oznaczenie stężenia peptydu C we krwi do celów diagnostycznych?
3. Przeanalizuj schemat syntezy jodotyroniny (ryc. 11.5). Opisz główne etapy ich syntezy oraz narysuj schemat regulacji syntezy i wydzielania hormonów tarczycy. Wyjaśnij główne objawy niedoczynności i nadczynności tarczycy. Dlaczego podczas stosowania tyroksyny jako leku należy stale monitorować poziom TSH we krwi?
4. Przeanalizuj sekwencję etapów syntezy kortyzolu (ryc. 11.8). Znajdź na schemacie etapy katalizowane przez enzymy, których defekt jest przyczyną zespołu nadnerczowo-płciowego.
5. Opisz schemat wewnątrzkomórkowego cyklu syntezy kortyzolu, zaczynając od oddziaływania ACTH z receptorem (ryc. 11.12), zastępując liczby nazwami zaangażowanych białek.
6. Narysuj schemat regulacji syntezy i wydzielania kortykosteroidów. Wyjaśnij przyczyny i objawy zespołu odstawienia sterydów.
7. Opisz sekwencję zdarzeń, która prowadzi do wzrostu stężenia glukozy we krwi w ciągu pierwszej godziny po posiłku i jego powrotu do wartości wyjściowych w ciągu 2 godzin (ryc. 11.13). Wyjaśnij rolę hormonów w tych zdarzeniach.
8. Analizuj zmiany stanu hormonalnego i metabolizmu w wątrobie, tkance tłuszczowej i mięśniach w okresie absorpcyjnym (ryc. 11.10) i poabsorpcyjnym (ryc. 11.11). Nazwij procesy oznaczone liczbami. Wskaż enzymy regulatorowe i mechanizm zmiany ich aktywności, biorąc pod uwagę, że pierwotnym sygnałem pobudzenia tych procesów jest zmiana stężenia glukozy we krwi i wzajemne zmiany stężenia insuliny i glukagonu (ryc. 11.11).
 Ryż. 11.12. Wewnątrzkomórkowy cykl syntezy kortyzolu:
Ryż. 11.12. Wewnątrzkomórkowy cykl syntezy kortyzolu:
ECS – estry cholesterolu; CS – cholesterol
ZADANIA SAMOKONTROLI
1. Wybierz prawidłowe odpowiedzi. Hormony:
A. Wykazują swoje działanie poprzez interakcję z receptorami B. Są syntetyzowane w tylnym płacie przysadki mózgowej
B. Zmiana aktywności enzymów poprzez częściową proteolizę. D. Indukowanie syntezy enzymów w komórkach docelowych
D. Synteza i wydzielanie są regulowane przez mechanizm sprzężenia zwrotnego
 Ryż. 11.13. Dynamika zmian stężeń glukozy (A), insuliny (B) i glukagonu (C) po spożyciu posiłku bogatego w węglowodany
Ryż. 11.13. Dynamika zmian stężeń glukozy (A), insuliny (B) i glukagonu (C) po spożyciu posiłku bogatego w węglowodany
2. Wybierz poprawną odpowiedź. Glukagon w tkance tłuszczowej aktywuje:
A. Wrażliwa na hormony lipaza TAG B. Dehydrogenaza glukozo-6-fosforanowa
B. Karboksylaza acetylo-CoA D. Lipaza LP
D. Kinaza pirogronianowa
3. Wybierz prawidłowe odpowiedzi. Jodotyroniny:
A. Syntetyzowany w przysadce mózgowej
B. Oddziałują z receptorami wewnątrzkomórkowymi
B. Stymuluj pracę Na, Ka-ATPazy
D. W dużych stężeniach przyspieszają procesy kataboliczne. E. Uczestniczą w reakcji na ochłodzenie
4. Mecz:
A. Choroba Gravesa-Basedowa B. Obrzęk śluzowaty
B. Wole endemiczne. D. Kretynizm
D. Autoimmunologiczne zapalenie tarczycy
1. Występuje przy niedoczynności tarczycy w młodym wieku
2. Towarzyszy temu gromadzenie się proteoglikanów i wody w skórze
3. Jest następstwem powstawania immunoglobuliny, która imituje działanie TSH
5. Wybierz prawidłowe odpowiedzi.
Okres wchłaniania charakteryzuje się:
A. Zwiększenie stężenia insuliny we krwi. B. Przyspieszenie syntezy tłuszczów w wątrobie
B. Przyspieszenie glukoneogenezy
D. Przyspieszenie glikolizy w wątrobie
D. Zwiększone stężenie glukagonu we krwi
6. Wybierz prawidłowe odpowiedzi.
Pod wpływem insuliny wątroba przyspiesza:
A. Biosynteza białek
B. Biosynteza glikogenu
B. Glukoneogeneza
D. Biosynteza kwasów tłuszczowych E. Glikoliza
7. Mecz. Hormon:
A. Insulina B. Glukagon
B. Kortyzol D. Adrenalina
Funkcjonować:
1. Stymuluje syntezę tłuszczów z glukozy w wątrobie
2. Stymuluje mobilizację glikogenu w mięśniach
3. Stymuluje syntezę jodotyroniny
8. Wybierz prawidłowe odpowiedzi. Hormony steroidowe:
A. Penetracja do komórek docelowych
B. Transportowany przez krew w połączeniu ze specyficznymi białkami
B. Stymuluj reakcje fosforylacji białek
D. Oddziałuj z chromatyną i zmieniaj tempo transkrypcji. E. Weź udział w procesie translacji.
9. Wybierz prawidłowe odpowiedzi. Insulina:
A. Przyspiesza transport glukozy do mięśni. B. Przyspiesza syntezę glikogenu w wątrobie
B. Stymuluje lipolizę w tkance tłuszczowej. D. Przyspiesza glukoneogenezę
D. Przyspiesza transport glukozy do adipocytów
1. A, G, D 6. A, B, D, D
2. A 7. 1-A, 2-G, 3-D
3. B, C, D, D 8. A, B, G
4. 1-G, 2-B, 3 - A 9. A, B, D
5. A, B, G
PODSTAWOWE TERMINY I POJĘCIA
2. Preprohormon
3. Bodźce syntezy i wydzielania
4. Komórki docelowe
5. Receptory
6. Hierarchia systemów regulacyjnych
7. Autokrynny mechanizm działania
8. Parakrynny mechanizm działania
9. Homeostaza
10. Okres absorpcji
11. Okres poabsorpcyjny
12. Adaptacja
13. Niedoczynność
14. Nadczynność
15. Hormony składowe
Rozwiązywać problemy
1. Podczas badania pacjentów z objawami hiperkortyzolizmu stosuje się test funkcjonalny z „ładunek” deksametazonu (deksametazon jest strukturalnym analogiem kortyzolu). Jak zmieni się stężenie 17-ketosteroidów w moczu pacjentów po podaniu deksametazonu, jeśli przyczyną hiperkortyzolemii jest:
a) nadmierna produkcja kortykotropiny;
b) hormonalnie czynny guz nadnerczy.
2. Rodzice pięcioletniej dziewczynki udali się do centrum medycznego na konsultację. W trakcie badania u dziecka wykazano objawy wtórnych męskich cech płciowych: przerost mięśni, nadmierny owłosienie, obniżenie barwy głosu. Zwiększa się poziom ACTH we krwi. Lekarz zdiagnozował zespół nadnerczowo-płciowy (wrodzona dysfunkcja kory nadnerczy). Uzasadnij diagnozę lekarza. Dla tego:
a) przedstawić schemat syntezy hormonów steroidowych; wymienić główne fizjologicznie aktywne kortykosteroidy i wskazać ich funkcje;
b) wymienić enzymy, których niedobór powoduje opisane powyżej objawy;
c) wskazać, których powstawanie produktów syntezy kortykosteroidów wzrasta w tej patologii;
d) wyjaśnić, dlaczego u dziecka występuje podwyższone stężenie ACTH we krwi.
3. Jedną z postaci choroby Addisona jest konsekwencja zaniku komórek kory nadnerczy podczas długotrwałego leczenia lekami kortykosteroidowymi. Główne objawy choroby: osłabienie mięśni, hipoglukozemia,
zmiany dystroficzne w mięśniach, obniżone ciśnienie krwi; w niektórych przypadkach u takich pacjentów występuje zwiększona pigmentacja skóry i błon śluzowych. Jak wyjaśnić wymienione objawy choroby? Dla wyjaśnienia:
a) przedstawić schemat syntezy hormonów steroidowych; wymienić główne fizjologicznie aktywne kortykosteroidy i wskazać ich funkcje;
b) wskazać, który niedobór kortykosteroidów powoduje hipoglikemię i dystrofia mięśniowa z tą chorobą;
c) podać przyczynę zwiększonej pigmentacji skóry w chorobie Addisona.
4. Lekarz przepisał pacjentowi N z niedoczynnością tarczycy leczenie obejmujące tyroksynę. Po 3 miesiącach od rozpoczęcia leczenia poziom TSH we krwi nieznacznie się obniżył. Dlaczego lekarz zalecił u tej pacjentki zwiększenie dawki tyroksyny? Odpowiedzieć:
a) przedstawić w formie diagramu mechanizm regulacji syntezy i wydzielania hormonów tarczycy;
5. 18-letnia dziewczyna z górskiej wioski zwróciła się do endokrynologa z dolegliwościami dotyczącymi ogólnego osłabienia, obniżonej temperatury ciała i pogorszenia nastroju. Pacjenta skierowano na badanie krwi na obecność TSH i jodotyroniny. Wyniki analizy wykazały wzrost stężenia TSH i spadek stężenia T4. Wyjaśnić:
a) jaką chorobę można podejrzewać u pacjenta;
b) jaka może być przyczyna takiej patologii;
c) czy istnieje związek pomiędzy miejscem zamieszkania a występowaniem tej choroby;
d) jaką dietę należy stosować, aby zapobiec tej patologii;
e) schemat regulacji syntezy jodotyroniny i wyniki badania krwi pacjenta.
6. W leczeniu wola rozlanego toksycznego stosuje się leki tyreostatyczne z grupy tionamidów (tiamazol). Mechanizm działania tionamidów polega na tym, że dostając się do tarczycy, hamują aktywność peroksydazy tarczycowej. Wyjaśnij skutek terapeutycznego działania tionamidów. Dla tego:
a) wymienić główne przyczyny i objawy kliniczne tyreotoksykozy;
b) podać schemat syntezy jodotyroniny i wskazać etapy działania leków;
c) wskazać, jak w wyniku leczenia zmieni się stężenie jodotyroniny i TSH;
d) opisać zmiany w metabolizmie podczas leczenia tionamidami.
Jednostka modułowa 2 ZMIANY BIOCHEMICZNE W METABOLIZMIE PODCZAS POSTU I CUKRZYCY
Cele nauczania Być w stanie:
1. Interpretować zmiany w metabolizmie węglowodanów, tłuszczów i białek podczas postu i wysiłku fizycznego w wyniku działania hormonów przeciwstawnych.
2. Analizować mechanizmy molekularne przyczyn cukrzycy.
3. Wyjaśniać mechanizmy powstawania objawów cukrzycy na skutek zmian szybkości procesów metabolicznych.
4. Zinterpretuj główne różnice w metabolizmie między postem a cukrzycą.
Wiedzieć:
1. Zmiany stanu hormonalnego podczas postu.
2. Zmiany w metabolizmie podstawowych nośników energii podczas postu.
3. Zmiany gospodarki hormonalnej i metabolizmu energetycznego w cukrzycy.
4. Główne objawy cukrzycy i mechanizmy ich występowania.
5. Patogeneza ostrych powikłań cukrzycy.
6. Biochemiczne podstawy późnych powikłań cukrzycy.
7. Podejścia do diagnostyki laboratoryjnej cukrzycy.
8. Molekularne mechanizmy zasad leczenia cukrzycy i obiecujące kierunki leczenie.
TEMAT 11.6. ZMIANY STANU HORMONALNEGO I METABOLIZMU PODCZAS POSTU I PRACY FIZYCZNEJ
1. W okresie poabsorpcyjnym i na czczo poziom glukozy w osoczu krwi spada do ok dolna granica normy. Zmniejsza się stosunek insuliny do glukagonu. W tych warunkach powstaje stan charakteryzujący się przewagą procesów katabolizmu tłuszczów, glikogenu i białek na tle ogólnego spadku tempa metabolizmu. Pod wpływem hormonów przeciwwyspowych w tym okresie następuje wymiana substratów pomiędzy wątrobą, tkanką tłuszczową, mięśniami i mózgiem. Ta wymiana służy dwóm celom:
Utrzymanie stężenia glukozy we krwi w wyniku glukoneogenezy w celu zaopatrzenia tkanek zależnych od glukozy (mózgu, czerwonych krwinek);
Mobilizacja innych cząsteczek „paliwa”, głównie tłuszczów, w celu dostarczenia energii wszystkim innym tkankom.
Manifestacja tych zmian pozwala z grubsza wyróżnić trzy fazy postu. W związku z przejściem metabolizmu na tryb mobilizacji nośników energii, nawet po 5-6 tygodniach postu, stężenie glukozy we krwi wynosi co najmniej 65 mg/dl. Główne zmiany podczas postu zachodzą w wątrobie, tkance tłuszczowej i mięśniach (ryc. 11.14).
2. Fazy postu. Głód może mieć charakter krótkotrwały – w ciągu jednego dnia (pierwsza faza), trwać tydzień (druga faza) lub kilka tygodni (trzecia faza).
W pierwsza faza stężenie insuliny we krwi zmniejsza się około 10-15 razy w porównaniu z okresem trawienia, wzrasta natomiast stężenie glukagonu i kortyzolu. Wyczerpują się zapasy glikogenu, wzrasta tempo mobilizacji tłuszczu i tempo glukoneogenezy z aminokwasów i gliceryny, stężenie glukozy we krwi spada do dolnej granicy normy (60 mg/dL).
 Ryż. 11.14. Zmiany w metabolizmie głównych nośników energii podczas postu:
Ryż. 11.14. Zmiany w metabolizmie głównych nośników energii podczas postu:
1 - spadek wskaźnika insulinowo-glukagonowego; 2 - mobilizacja glikogenu; 3, 4 - transport GLA do mózgu i erytrocytów; 5 - mobilizacja TAG; 6 - transport kwasów tłuszczowych do mięśni; 7 - synteza ciał ketonowych; 8 - transport kwasów tłuszczowych w wątrobie; 9 - transport AK do wątroby; 10 - glukoneogeneza z AK; 11 - transport mleczanu do wątroby; 12 - transport gliceryny do wątroby. Linia przerywana wskazuje procesy, których prędkość maleje
W druga faza mobilizacja tłuszczów trwa, wzrasta stężenie kwasów tłuszczowych we krwi, szybkość tworzenia ciał ketonowych w wątrobie i odpowiednio wzrasta ich stężenie we krwi; wyczuwalny jest zapach acetonu, który wydziela się wraz z wydychanym powietrzem i potem poszczącej osoby. Glukoneogeneza trwa nadal w wyniku rozkładu białek tkankowych.
W trzecia faza zmniejsza się szybkość rozpadu białek i szybkość glukoneogenezy z aminokwasów. Tempo metabolizmu zwalnia. Bilans azotowy ujemny we wszystkich fazach postu. Dla mózgu ciała ketonowe stają się obok glukozy ważnym źródłem energii.
3. Zmiany w metabolizmie podstawowych nośników energii w czasie postu. Metabolizm węglowodanów. Zapasy glikogenu w organizmie wyczerpują się podczas 24-godzinnego postu. Zatem dzięki mobilizacji glikogenu zapewniony jest jedynie krótkotrwały post. Głównym procesem dostarczającym tkankom glukozę podczas postu jest glukoneogeneza. Glukoneogeneza zaczyna przyspieszać 4-6 godzin po ostatnim posiłku i staje się jedynym źródłem glukozy w okresach długotrwałego postu. Głównymi substratami glukoneogenezy są aminokwasy, glicerol i mleczan.
4. Metabolizm tłuszczów i ciał ketonowych. Głównym źródłem energii w pierwszych dniach postu są kwasy tłuszczowe, które powstają z TAG w tkance tłuszczowej. W wątrobie następuje przyspieszenie syntezy ciał ketonowych. Synteza ciał ketonowych rozpoczyna się już w pierwszych dniach postu. Ciała ketonowe wykorzystywane są głównie w mięśniach. Zapotrzebowanie energetyczne mózgu jest częściowo zaspokajane przez ciała ketonowe. Po 3 tygodniach postu tempo utleniania ciał ketonowych w mięśniach spada i mięśnie zużywają prawie wyłącznie kwasy tłuszczowe. Wzrasta stężenie ciał ketonowych we krwi. Wykorzystanie ciał ketonowych przez mózg trwa nadal, ale staje się mniej aktywne ze względu na zmniejszenie tempa glukoneogenezy i zmniejszenie stężenia glukozy.
5. Metabolizm białek. W ciągu pierwszych kilku dni postu białka mięśniowe, główne źródło substratów do glukoneogenezy, ulegają szybkiemu rozkładowi. Po kilku tygodniach postu tempo glukoneogenezy z aminokwasów spada, głównie na skutek zmniejszonego zużycia glukozy i wykorzystania ciał ketonowych w mózgu. Zmniejszenie tempa glukoneogenezy z aminokwasów jest konieczne w celu ochrony białek, ponieważ utrata 1/3 wszystkich białek może prowadzić do śmierci. Czas trwania postu zależy od tego, jak długo można syntetyzować i wykorzystywać ciała ketonowe. Jednakże szczawiooctan i inne składniki cyklu TCA są wymagane do utleniania ciał ketonowych. Zwykle powstają z glukozy i aminokwasów, a podczas postu tylko z aminokwasów.
TEMAT 11.7. ZMIANY STANU HORMONALNEGO I METABOLIZMU W CUKRZYCY
1. Cukrzyca występuje na skutek względnego lub całkowitego niedoboru insuliny. Według klasyfikacji WHO wyróżnia się dwie główne formy choroby: cukrzycę typu I – insulinozależne (IDDM), i cukrzycę typu II (INSD)- niezależny od insuliny.
2. IDDM jest konsekwencją zniszczenia komórek β wysp Langerhansa w wyniku reakcji autoimmunologicznych. Cukrzyca typu I może być spowodowana infekcją wirusową, która powoduje zniszczenie komórek β. Wirusy te obejmują ospę, różyczkę, odrę, wirus cytomegalii, świnkę, wirus Coxsackie i adenowirus. IDDM stanowi około 25-30% wszystkich przypadków cukrzycy. Z reguły zniszczenie komórek β następuje powoli, a początkowi choroby nie towarzyszą zaburzenia metaboliczne. Kiedy 80-95% komórek obumiera, następuje całkowity niedobór insuliny i rozwijają się poważne zaburzenia metaboliczne. IDDM dotyka najczęściej dzieci, młodzież i młodych dorosłych, ale może pojawić się w każdym wieku (począwszy od pierwszego roku życia).
3. NIDSD rozwija się z powodu naruszenia konwersji proinsuliny do insuliny, regulacji wydzielania insuliny, zwiększonego tempa katabolizmu insuliny, uszkodzenia mechanizmów przekazywania sygnału insuliny do komórek docelowych (na przykład defekt receptora insuliny, uszkodzenie mediatorów wewnątrzkomórkowych sygnału insuliny itp.), powstawanie przeciwciał przeciwko receptorom insuliny i stężenie insuliny we krwi może być prawidłowe lub nawet zwiększone. Do czynników determinujących rozwój i przebieg kliniczny choroby zalicza się otyłość, niewłaściwą dietę, siedzący tryb życia i stres. NIDDM dotyka zwykle osoby po 40. roku życia, rozwija się stopniowo, a objawy są umiarkowane. Ostre powikłania są rzadkie.
4. Zmiany metaboliczne w cukrzycy. W cukrzycy z reguły stosunek insuliny do glukagonu jest zmniejszony. Jednocześnie słabnie pobudzenie procesów odkładania glikogenu i tłuszczów, a wzrasta mobilizacja rezerw energetycznych. Wątroba, mięśnie i tkanka tłuszczowa funkcjonują w stanie poabsorpcyjnym nawet po jedzeniu.
5. Objawy cukrzycy. Hiperglukozemia. Wszystkie formy cukrzycy charakteryzują się podwyższonym stężeniem glukozy we krwi - hiperglukozemia, zarówno po posiłkach, jak i na czczo, a także cukromocz. Po posiłku stężenie glukozy może sięgać 300-500 mg/dl i utrzymuje się na wysokim poziomie w okresie poabsorpcyjnym, tj. spada tolerancja glukozy.
Zmniejszenie tolerancji glukozy obserwuje się również w przypadkach utajonej (utajonej) cukrzycy. W tych przypadkach ludzie nie mają dolegliwości i objawów klinicznych charakterystycznych dla cukrzycy, a stężenie glukozy we krwi na czczo odpowiada górnej granicy normy. Jednak zastosowanie testów prowokacyjnych (na przykład obciążenia cukrem) ujawnia zmniejszenie tolerancji glukozy (ryc. 11.15).
Wzrost stężenia glukozy w osoczu w IDDM wynika z kilku przyczyn. Wraz ze spadkiem indeksu insulinowo-glukagonowego wzrasta działanie hormonów przeciwwyspowych, zmniejsza się liczba białek transportujących glukozę (GLUT-4) na błonach komórek insulinozależnych (tkanka tłuszczowa i mięśnie). W rezultacie zużycie glukozy przez te komórki jest zmniejszone. W mięśniach i wątrobie glukoza nie jest magazynowana w postaci glikogenu, w tkance tłuszczowej zmniejsza się tempo syntezy i magazynowania tłuszczów. Dodatkowo działanie hormonów małżowinowych, przede wszystkim glukagonu, aktywuje glukoneogenezę z aminokwasów, gliceryny i mleczanu. Wzrost poziomu glukozy we krwi w cukrzycy powyżej progu stężenia nerkowego wynoszącego 180 mg/dl powoduje wydalanie glukozy z moczem.
Ketonemia jest charakterystycznym objawem cukrzycy. Przy niskim stosunku insuliny do glukagonu tłuszcze nie odkładają się, ich katabolizm przyspiesza, ponieważ lipaza wrażliwa na hormony w tkance tłuszczowej występuje w aktywnej fosforylowanej formie. Zwiększa się stężenie nieestryfikowanych kwasów tłuszczowych we krwi. Wątroba pobiera kwasy tłuszczowe i utlenia je do acetylo-CoA, który z kolei
 Ryż. 11.15. Zmiany tolerancji glukozy u pacjentów ukryta forma cukrzyca
Ryż. 11.15. Zmiany tolerancji glukozy u pacjentów ukryta forma cukrzyca
Oznaczenie tolerancji glukozy służy do diagnozowania cukrzycy. Pacjent przyjmuje roztwór glukozy w ilości 1 g na 1 kg masy ciała (ładunek cukru). Stężenie glukozy we krwi mierzy się przez 2-3 godziny w 30-minutowych odstępach. 1 - u osoby zdrowej, 2 - u pacjenta chorego na cukrzycę
ulega przemianie do kwasu β-hydroksymasłowego i acetooctowego, co powoduje wzrost stężenia ciał ketonowych we krwi - ketonemia. W tkankach acetooctan ulega częściowej dekarboksylacji do acetonu, którego zapach pochodzi od chorych na cukrzycę i jest wyczuwalny nawet na odległość. Wzrost stężenia ciał ketonowych we krwi (powyżej 20 mg/dl, czasem nawet do 100 mg/dl) prowadzi do: ketonuria. Nagromadzenie ciał ketonowych zmniejsza zdolność buforową krwi i powoduje kwasica (kwasica ketonowa).
Hiperlipoproteinemia. Tłuszcze pokarmowe nie odkładają się w tkance tłuszczowej ze względu na osłabione procesy magazynowania i niską aktywność LP-lipazy, ale przedostają się do wątroby, gdzie przekształcają się w triacyloglicerole, które są transportowane z wątroby w ramach VLDL.
Azotemia. W cukrzycy niedobór insuliny prowadzi do zmniejszenia tempa syntezy i zwiększonego rozkładu białek w organizmie. Powoduje to wzrost stężenia aminokwasów we krwi. Aminokwasy dostają się do wątroby i ulegają deaminacji. Wolne od azotu reszty aminokwasów glikogennych biorą udział w glukoneogenezie, co dodatkowo nasila hiperglikemię. Powstały w tym przypadku amoniak wchodzi w cykl ornitynowy, co prowadzi do wzrostu stężenia mocznika we krwi i odpowiednio w moczu - azotemia I azoturia.
Wielomocz. Aby usunąć duże ilości glukozy, ciał ketonowych i mocznika, wymagana jest duża objętość płynu, co może skutkować odwodnieniem. Wyjaśnia to osobliwość zdolności koncentracji nerek. Na przykład wydalanie moczu u pacjentów wzrasta kilkakrotnie i w niektórych przypadkach osiąga 8-9 litrów dziennie, ale częściej nie przekracza 3-4 litrów. Ten objaw nazywa się wielomocz. Utrata wody powoduje ciągłe pragnienie i zwiększone zużycie wody - polidypsja.
6. Ostre powikłania cukrzycy. Mechanizmy rozwoju śpiączki cukrzycowej. Zaburzenia metabolizmu węglowodanów, tłuszczów i białek w cukrzycy mogą prowadzić do rozwoju stanów śpiączki (ostrych powikłań). Śpiączka cukrzycowa objawia się nagłym zaburzeniem wszystkich funkcji organizmu, któremu towarzyszy utrata przytomności. Głównymi prekursorami śpiączki cukrzycowej są kwasica i odwodnienie tkanek (ryc. 11.16).
Wraz z dekompensacją cukrzycy rozwija się naruszenie metabolizmu wody i elektrolitów. Powodem tego jest hiperglukozemia, której towarzyszy wzrost ciśnienia osmotycznego w łożysku naczyniowym. Aby utrzymać osmolarność, rozpoczyna się kompensacyjny ruch płynu z komórek i przestrzeni zewnątrzkomórkowej łożysko naczyniowe. Prowadzi to do utraty przez tkanki wody i elektrolitów, przede wszystkim jonów Na+, K+, Cl -, HCO 3 -. W efekcie dochodzi do ciężkiego odwodnienia komórek i niedoboru jonów wewnątrzkomórkowych (głównie K+), któremu towarzyszy ogólne odwodnienie. Prowadzi to do zmniejszenia krążenia obwodowego, zmniejszenia przepływu krwi w mózgu i nerkach oraz niedotlenienia. Śpiączka cukrzycowa rozwija się powoli przez kilka dni, ale czasami może
 Ryż. 11.16. Zmiany metaboliczne w cukrzycy i przyczyny śpiączki cukrzycowej
Ryż. 11.16. Zmiany metaboliczne w cukrzycy i przyczyny śpiączki cukrzycowej
nastąpić w ciągu kilku godzin. Pierwszymi objawami mogą być nudności, wymioty, letarg. Ciśnienie krwi u pacjentów jest obniżone.
Stany śpiączki w cukrzycy mogą objawiać się trzema głównymi postaciami: kwasicą ketonową, hiperosmolarną i kwasicą mleczanową.
Śpiączka ketonowa charakteryzuje się ciężkim niedoborem insuliny, kwasicą ketonową, wielomoczem i polidypsją. Hiperglikemii (20-30 mmol/l), spowodowanej niedoborem insuliny, towarzyszą duże straty płynów i elektrolitów, odwodnienie i hiperosmolarność osocza. Całkowite stężenie ciał ketonowych osiąga 100 mg/dL i więcej.
Na hiperosmolarny w śpiączce występuje niezwykle wysoki poziom glukozy w osoczu krwi, wielomocz, polidypsja i zawsze pojawia się ciężkie odwodnienie. Przyjmuje się, że u większości pacjentów hiperglikemia jest spowodowana współistniejącą dysfunkcją nerek. Ciała ketonowe w surowicy krwi są zwykle niewykrywalne.
Na kwasica mleczanowa W śpiączce dominuje niedociśnienie, zmniejszenie krążenia obwodowego i niedotlenienie tkanek, co prowadzi do przesunięcia metabolizmu w kierunku glikolizy beztlenowej, co powoduje wzrost stężenia kwasu mlekowego we krwi (kwasica mleczanowa).
7. Późne powikłania cukrzycy są konsekwencją długotrwałej hiperglikemii i często prowadzą do wczesnej niepełnosprawności pacjentów. Hiperglukozemia prowadzi do uszkodzenia naczyń krwionośnych i dysfunkcji różnych tkanek i narządów. Jednym z głównych mechanizmów uszkodzenia tkanek w cukrzycy jest glukozylacja białek i związana z nimi dysfunkcja komórek tkankowych, zmiany Właściwości reologiczne krew i hemodynamika (płynność, lepkość).
Niektóre związki zwykle zawierają składniki węglowodanowe (glikoproteiny, proteoglikany, glikolipidy). Synteza tych związków zachodzi w wyniku reakcji enzymatycznych (enzymatycznej glukozylacji). Jednak w organizmie człowieka może również zachodzić nieenzymatyczne oddziaływanie grupy aldehydowej glukozy z wolnymi grupami aminowymi białek (nieenzymatyczna glukozylacja). W tkankach osób zdrowych proces ten przebiega powoli, jednak przy hiperglikemii przyspiesza.
Jednym z pierwszych objawów cukrzycy jest 2-3-krotny wzrost stężenia hemoglobiny glukozylowanej. Przez całe życie erytrocytów glukoza swobodnie przenika przez ich błonę i bez udziału enzymów nieodwracalnie wiąże się z hemoglobiną, głównie z łańcuchami β. W ten sposób powstaje glukozylowana postać hemoglobiny HbA 1c. Ta forma hemoglobiny występuje również w małych ilościach u zdrowych ludzi. W stanach przewlekłej hiperglikemii wzrasta procent HbA 1c w stosunku do całkowitej ilości hemoglobiny.
Stopień glukozylacji białek zależy od szybkości ich obrotu. Więcej zmian kumuluje się w wolno obracających się białkach. Do białek wolno wymieniających zaliczają się białka międzykomórkowe
matryca, błony podstawne, soczewka oka (krystaliny). Pogrubienie błon podstawnych jest jednym z wczesnych i trwałych objawów cukrzycy, objawiającym się angiopatią cukrzycową.
Nazywa się zmiany objawiające się zmniejszeniem elastyczności tętnic, uszkodzeniem dużych i średnich naczyń mózgu, serca i kończyn dolnych makroangiopatie cukrzycowe. Powstają w wyniku glukozylacji białek macierzy międzykomórkowej – kolagenu i elastyny, co prowadzi do zmniejszenia elastyczności naczyń krwionośnych i złego krążenia.
Na skutek uszkodzenia naczyń włosowatych i małych naczyń – m.in ikroangiopatie objawiają się w postaci nefro- i retinopatii. Przyczyną niektórych późnych powikłań cukrzycy (zaćma, retinopatia) może być zwiększenie szybkości przemiany glukozy w sorbitol. Sorbitol nie jest stosowany w innych szlakach metabolicznych, a szybkość jego dyfuzji z komórek jest niska. U pacjentów chorych na cukrzycę sorbitol gromadzi się w siatkówce i soczewce oka, komórkach kłębuszkowych nerek, komórkach Schwanna i śródbłonku. Sorbitol w wysokich stężeniach jest toksyczny dla komórek. Jego akumulacja w neuronach prowadzi do wzrostu ciśnienia osmotycznego, obrzęku komórek i obrzęku tkanek. Zmętnienie soczewki, czyli zaćma, może rozwinąć się zarówno w wyniku obrzęku soczewki spowodowanego nagromadzeniem sorbitolu i zaburzeniem uporządkowanej struktury krystalin, jak i w wyniku glukozylacji krystalin, które tworzą wielocząsteczkowe agregaty zwiększające siłę refrakcyjną obiektywu.
ZADANIA NA PRACĘ POZASZKOLNĄ
1. Spójrz na rys. 11.14, narysuj schematy procesów przyspieszających w wątrobie i innych tkankach na początku okresu poabsorpcyjnego, zapisz nazwy szlaków metabolicznych i odpowiadających im enzymów regulatorowych.
2. Przeanalizuj zmiany metaboliczne przedstawione na ryc. 11.10 i 11.11 i porównać je ze zmianami pokazanymi na rys. 11.14. Dla tego:
a) wymienić procesy, które są aktywowane i hamowane podczas długotrwałego postu;
b) wybrać i napisać schematy procesów utrzymujących stężenie glukozy we krwi podczas długotrwałego postu;
c) dla każdego wybranego procesu wskazać kluczowe enzymy i hormony
mons, pod wpływem których następuje ich aktywacja;
d) wybierać i pisać diagramy procesów, poprzez które
dostarczanie energii mięśniom podczas długotrwałego postu.
3. Przeanalizuj schemat zmian metabolicznych w cukrzycy (ryc. 11.16). Wyjaśnij przyczyny wystąpienia hiperglikemii. Zapisz nazwy szlaków metabolicznych, które w tych warunkach ulegają przyspieszeniu.
4. Wyjaśnij przyczyny i mechanizmy kwasicy ketonowej w cukrzycy i narysuj odpowiedni diagram.
5. Porównaj zmiany w stanie hormonalnym i metabolizmie podczas cukrzycy i na czczo (ryc. 11.14 i 11.16). Wyjaśnij, dlaczego na tle hiperglikemii w cukrzycy zachodzi katabolizm tłuszczów i białek.
6. Wymień główne objawy cukrzycy. Uzasadnij słuszność wyrażenia: „cukrzyca to głód wśród obfitości”. Dla tego:
a) wymienić objawy cukrzycy podobne do zmian w metabolizmie podczas postu;
b) wyjaśnić przyczyny tych zmian;
c) wymienić główne różnice w metabolizmie podczas cukrzycy i na czczo.
7. Kontynuuj wypełnianie tabeli późnych powikłań cukrzycy (tabela 11.2):
Tabela 11.2. Późne powikłania cukrzycy
ZADANIA SAMOKONTROLI
1. Wybierz poprawną odpowiedź.
Podczas postu:
A. Karboksylaza acetylo-CoA jest fosforylowana i aktywna B. Wrażliwa na hormony lipaza TAG jest nieaktywna
B. Lipaza LP jest aktywna w tkance tłuszczowej
D. Kinaza pirogronianowa w wątrobie jest fosforylowana i aktywna D. Kinaza białkowa zależna od cAMP jest aktywna w adipocytach
2. Wybierz prawidłowe odpowiedzi. Podczas trzydniowego postu:
A. Indeks insulinowo-glukagonowy jest obniżony
B. Zwiększa się tempo glukoneogenezy z aminokwasów
B. Zmniejsza się szybkość syntezy TAG w wątrobie D. Zmniejsza się szybkość β-oksydacji w wątrobie
D. Stężenie ciał ketonowych we krwi jest wyższe niż normalnie
3. Wybierz prawidłowe odpowiedzi.
Wzrost tempa syntezy ciał ketonowych w czasie postu jest konsekwencją:
A. Spadek poziomu glukagonu
B. Zmniejszone tworzenie się acetylo-CoA w wątrobie
B. Zwiększone stężenie kwasów tłuszczowych w osoczu krwi D. Zmniejszenie szybkości β-oksydacji w wątrobie
D. Zmniejszenie aktywności hormonowrażliwej lipazy TAG w adipocytach
4. Wybierz prawidłowe odpowiedzi.
W cukrzycy w wątrobie zachodzą:
A. Przyspieszenie syntezy glikogenu
B. Zwiększone tempo glukoneogenezy
B. Zmniejszone tempo syntezy tłuszczu
D. Zwiększenie szybkości syntezy acetooctanu
D. Zwiększona aktywność karboksylazy acetylo-CoA
5. Mecz:
A. Wysoki poziom insuliny. B. Alkaloza
B. Hipoglukozemia
D. Wysoki poziom kortyzolu
D. Autoimmunologiczne uszkodzenie komórek β
1. Tylko na cukrzycę
2. Tylko podczas postu
3. Tylko w przypadku cukrzycy sterydowej
6. Wybierz prawidłowe odpowiedzi.
Dzięki IDDM pacjenci najczęściej stwierdzają:
A. Hiperglukozemia
B. Wysokie tempo katabolizmu insuliny
B. Stężenie insuliny we krwi jest prawidłowe lub wyższe niż prawidłowe D. Przeciwciała przeciwko komórkom β trzustki
D. Mikroangiopatie
7. Mecz:
A. Makroangiopatia B. Zaćma
B. Mikroangiopatie G. Nefropatia
D. Neuropatie
1. Aktywacja szlaku sorbitolu w komórkach Schwanna
2. Glukozylacja krystalin
3. Pogrubienie błon podstawnych kłębuszków
STANDARDY ODPOWIEDZI NA „ZADANIA SAMOKONTROLI”
2. A, B, C, D
4. B, C, D
5. 1-D, 2-B, 3-G
6. A, G, D
7. 1-D, 2-B, 3-G
PODSTAWOWE TERMINY I POJĘCIA
1. Post
2. Fazy postu
3. Cukrzyca
6. Hiperglukozemia – cukromocz
7. Ketonemia – ketonuria
8. Azotemia - azoturia
9. Późne powikłania cukrzycy
10. Śpiączka cukrzycowa
11. Śpiączka ketonowa
12. Śpiączka hiperosmolarna
13. Śpiączka mleczanowa
14. Mikroangiopatie
15. Makroangiopatie
16. Neuropatie
17. Nefropatia
ZADANIA DO PRACY W KLASIE
Rozwiązywać problemy
1. Turyści nie kalkulowali swoich zapasów żywności i do czasu dotarcia do pierwszej osady zmuszeni byli głodować przez 2 dni. Jakie zmiany w metabolizmie wystąpią u tych turystów? Dla wyjaśnienia:
a) wskazać, jak zmieni się stężenie glukozy we krwi turystów do końca drugiego dnia postu;
b) napisz diagramy procesów, dzięki aktywacji których utrzymuje się prawidłowe stężenie glukozy w pierwszym dniu postu;
c) wymienić hormony regulujące poziom glukozy w tym okresie;
d) przedstawić w formie diagramu mechanizm działania tych hormonów;
e) wskazać reakcje regulacyjne tych szlaków i sposoby ich aktywacji.
2. Badania biochemiczne krwi i moczu pacjenta z cukrzycą typu I wykazały:
Jak zmienią się te wskaźniki po jednorazowym wstrzyknięciu pacjentowi średniej dziennej dawki insuliny? W wyniku aktywacji jakich procesów nastąpią te zmiany?
3. Pacjent zgłosił się do terapeuty ze skargami na postępujące osłabienie, senność i zawroty głowy. Objawy nasiliły się w czasie postu, co pozwoliło lekarzowi przypuszczać, że pacjent cierpi na hipoglikemię. Badanie krwi potwierdziło przypuszczenie (poziom glukozy poniżej 2,5 mmol/l), a także wykazało bardzo podwyższony poziom peptydu C (ponad 800 pmol/l). Pacjentka nie choruje na cukrzycę i nie przyjmuje leków hipoglikemizujących. Jaką chorobę można podejrzewać? Odpowiadając na pytanie:
a) wymienić bodźce wpływające na wydzielanie insuliny;
b) opisać wpływ insuliny na metabolizm węglowodanów i tłuszczów w wątrobie, tkance tłuszczowej i mięśniach;
c) wyjaśnić, dlaczego hipoglukozemia jest niebezpieczna i jakie procesy zachodzące w organizmie normalnie zapobiegają rozwojowi hipoglikemii nawet podczas postu;
d) nazwać chorobę i zaproponować sposób leczenia.
4. Pacjent N skarżył się na ciągłe uczucie głodu, pragnienia, zmęczenia i znużenia. Oznaczenie stężenia glukozy na czczo wykazało 130 mg/dl. Jakie dodatkowe badania należy przeprowadzić, aby postawić diagnozę w tym przypadku? Jakie wyniki można przewidzieć, jeśli u pacjenta zostanie zdiagnozowana cukrzyca typu II?
5. Pacjent, u którego zdiagnozowano IDDM, przez długi czas nie otrzymywał zastrzyków insuliny. Po konsultacji lekarskiej i dokładnym badaniu pacjentowi przepisuje się insulinoterapię. Po 2 miesiącach oznaczenie glukozy we krwi na czczo wykazało 85 mg/dl, poziom hemoglobiny glukozylowanej 14% poziom ogólny hemoglobina (normalna 5,8-7,2%).
Czym są możliwe przyczyny wysokie stężenie hemoglobiny glukozylowanej u tej pacjentki pomimo leczenia? Podaj przykłady glukozylacji innych białek. Wyjaśnij, do jakich powikłań może to prowadzić.
6. 39-letni pacjent został przyjęty z powodu dolegliwości związanych z silnym pragnieniem i zmęczeniem. Pomimo tego utrata masy ciała w ciągu ostatnich 5 tygodni wyniosła 4 kg dobry apetyt i normalną aktywność fizyczną. Badanie krwi wykazało, że stężenie glukozy 2 godziny po posiłku wynosiło 242 mg/dl. Jaką chorobę można podejrzewać u tego pacjenta? Co powoduje pragnienie? Jak wytłumaczyć szybkie zmęczenie pacjenta?
Jednostka modułowa 3 REGULACJA METABOLIZMU WODY-SOLI. ROLA WAZOPRESYNY, ALDOSTERONU I UKŁADU RENINA-ANGIOTENSYNA. REGULACJA METABOLIZMU CA 2 + I FOSFORANÓW
Cele nauczania Być w stanie:
1. Analizować zmiany metaboliczne zachodzące przy określonych zaburzeniach gospodarki wodno-solnej (hiperaldosteronizm, nadciśnienie nerkowe).
2. Interpretować molekularne mechanizmy zaburzeń syntezy i wydzielania hormonów zapewniających regulację gospodarki wapniowej.
Wiedzieć:
1. Charakterystyka głównych hormonów VSO i etapy jego regulacji.
2. Główne funkcje wapnia w organizmie.
3. Mechanizmy hormonalnej regulacji wymiany jonów wapnia i fosforanów.
4. Objawy niektórych zaburzeń syntezy i wydzielania hormonów regulujących metabolizm wapnia i fosforanów (niedoczynność i nadczynność przytarczyc, krzywica).
TEMAT 11.8. REGULACJA METABOLIZMU WODY I SOLI
1. Główne parametry homeostaza woda-sól są ciśnienie osmotyczne, pH i objętość płynu wewnątrzkomórkowego i zewnątrzkomórkowego. Zmiany tych parametrów mogą prowadzić do zmian ciśnienia krwi, kwasicy lub zasadowicy, odwodnienia i obrzęków. Głównymi hormonami biorącymi udział w regulacji równowagi wodno-solnej są hormon antydiuretyczny (ADH), aldosteron I przedsionkowy czynnik natriuretyczny (ANF).
2. Hormon antydiuretyczny(ADG), czyli wazopresyna, to peptyd zawierający dziewięć aminokwasów połączonych jednym mostkiem dwusiarczkowym. Jest syntetyzowany jako prohormon w podwzgórzu, następnie transportowany do zakończeń nerwowych tylnego płata przysadki mózgowej, skąd po odpowiedniej stymulacji jest wydzielany do krwiobiegu. Ruch wzdłuż aksonu jest powiązany ze specyficznym białkiem nośnikowym (neurofizyną) (ryc. 11.17).
Bodźcem powodującym wydzielanie ADH jest wzrost stężenia jonów sodu i wzrost ciśnienia osmotycznego płynu pozakomórkowego.
Najważniejszymi komórkami docelowymi dla ADH są komórki kanalików dystalnych i przewodów zbiorczych nerek. Komórki tych przewodów są stosunkowo nieprzepuszczalne dla wody, a przy braku ADH mocz nie jest zagęszczony i może być wydalany w ilościach przekraczających 20 litrów na dobę (norma to 1-1,5 litra na dobę).
 Ryż. 11.17. Wydzielanie i mechanizm działania hormonu antydiuretycznego:
Ryż. 11.17. Wydzielanie i mechanizm działania hormonu antydiuretycznego:
A: 1 - neuron nadwzrokowy; 2 - neuron przykomorowy; 3 - przedni płat przysadki mózgowej; 4 - tylny płat przysadki mózgowej; 5 - neurofizyna ADH; B: 1 - ADH wiąże się z receptorem błonowym V 2, powodując aktywację cyklazy adenylanowej (AC) i w konsekwencji powstanie cAMP; 2 - cAMP aktywuje kinazę białkową, która fosforyluje białka; 3 - fosforylowane białka indukują transkrypcję genu białka akwaporyny; 4 - akwaporyna jest zintegrowana z błoną komórkową kanalików nerkowych
Istnieją dwa typy receptorów dla ADH – V 1 i V 2. Receptor V2 znaleźć tylko na powierzchni komórki nabłonkowe nerka Wiązanie ADH z V2 jest związane z układem cyklazy adenylanowej i stymuluje aktywację kinazy białkowej (PKA), która fosforyluje białka stymulujące ekspresję genu białka błonowego – akwaporyny-2. Akwaporyna-2 przemieszcza się do błony wierzchołkowej, integruje się z nią i tworzy kanały wodne, przez które cząsteczki wody swobodnie dyfundują do komórek
kanalików nerkowych, a następnie przedostają się do przestrzeni śródmiąższowej. W rezultacie woda jest ponownie wchłaniana z kanalików nerkowych (patrz ryc. 11.17). Receptory typu V zlokalizowane w błonach mięśni gładkich. Oddziaływanie ADH z receptorem V 1 prowadzi do aktywacji fosfolipazy C, w wyniku czego następuje uwolnienie Ca 2 + z siateczki śródplazmatycznej i skurcz warstwy mięśni gładkich naczyń krwionośnych.
3. moczówka prosta cukrzycowa. Niedobór ADH, spowodowany dysfunkcją tylnego płata przysadki mózgowej, a także zaburzeniem w układzie przekazywania sygnałów hormonalnych, może prowadzić do rozwoju moczówka prosta cukrzycowa. Głównym objawem moczówki prostej jest wielomocz, te. wydalanie dużych ilości moczu o małej gęstości.
4. Aldosteron- najbardziej aktywny mineralokortykosteroid - jest syntetyzowany przez komórki warstwy kłębuszkowej kory nadnerczy z cholesterolu. Syntezę i wydzielanie aldosteronu stymulują niskie stężenia Na+, wysokie stężenia K+ oraz układ renina-angiotensyna. Hormon wnika do komórek kanalików nerkowych, oddziałuje ze specyficznym receptorem, cytoplazmatycznym lub jądrowym (ryc. 11.18) i indukuje syntezę białek zapewniających ponowne wchłanianie jonów sodu i wydalanie jonów potasu.
Ponadto białka, których synteza jest indukowana przez aldosteron, zwiększają liczbę pomp Na+, K+ - ATPaza, a także pełnią funkcję enzymów cyklu TCA, który generuje cząsteczki ATP do aktywnego transportu jonów. Ogólnym skutkiem działania aldosteronu jest zatrzymywanie NaCl w organizmie.
5. Główną rolę w regulacji równowagi wodno-solnej, a co za tym idzie regulacji objętości krwi i ciśnienia krwi, pełni układ renina-angiotensynaldosteron(ryc. 11.19).
Enzym proteolityczny renina syntetyzowany przez komórki przykłębuszkowe tętniczek doprowadzających nerki. Spadek ciśnienia krwi w tętniczkach doprowadzających, utrata płynu lub krwi oraz spadek stężenia NaCl stymulują uwalnianie reniny. Białko produkowane w wątrobie angiotensynogen hydrolizowany przez reninę z wytworzeniem angiotensyny I, która z kolei służy jako substrat dla ACE (enzymu konwertującego angiotensynę, karboksydipentydylopeptydazy). Dipeptyd jest odszczepiany od angiotensyny I, tworząc angiotensynę II. Poprzez układ fosforanu inozytolu a ngiotensyna II stymuluje syntezę i wydzielanie aldosteronu. Będąc również silnym środkiem zwężającym naczynia, angiotensyna II powoduje skurcz komórek mięśni gładkich naczyń krwionośnych, odpowiednio wzrost ciśnienia krwi, a ponadto powoduje pragnienie.
6. Zapewnia układ renina-angiotensyna-aldosteron przywrócenie objętości krwi, które mogą ulec zmniejszeniu w wyniku krwawienia, obfite wymioty, biegunka, pocenie się – stany, które są sygnałem
 Ryż. 11.18. Mechanizm działania aldosteronu.
Ryż. 11.18. Mechanizm działania aldosteronu.
Aldosteron oddziałując z receptorami wewnątrzkomórkowymi stymuluje syntezę białek. Białkami tymi mogą być:
1 - komponenty kanały sodowe i zwiększają wchłanianie zwrotne Na + z moczu;
2 - Enzymy cyklu TCA, których działanie zapewnia produkcję ATP; 3 - Na+, K+ - ATPaza, pompa utrzymująca wewnątrzkomórkowe niskie stężenie jonów sodu i wysokie stężenie jonów potasu
uwalnianie reniny. Sprzyja temu również zmniejszenie impulsu z baroreceptorów przedsionków i tętnic w wyniku zmniejszenia objętości płynu wewnątrznaczyniowego. W rezultacie zwiększa się tworzenie angiotensyny II i odpowiednio wzrasta stężenie aldosteronu we krwi, powodując zatrzymywanie jonów sodu. Służy to jako sygnał dla osmoreceptorów podwzgórza i wydzielania ADH z zakończeń nerwowych przedniego płata przysadki mózgowej, co stymuluje ponowne wchłanianie wody z przewodów zbiorczych. Angiotensyna II, wykazując silne działanie zwężające naczynia krwionośne, podnosi ciśnienie krwi, a także wzmaga pragnienie. Woda powstająca podczas picia jest zatrzymywana w organizmie w większym stopniu niż normalnie.
 Ryż. 11.19. Układ renina-angiotensyna-aldosteron.
Ryż. 11.19. Układ renina-angiotensyna-aldosteron.
ACE – enzym konwertujący angiotensynę (inna nazwa dipeptydazy karboksypeptydylowej)
Zmniejszenie objętości płynów i obniżenie ciśnienia krwi aktywują układ renina-angiotensyna-aldosteron;
Angiotensyna II powoduje krótkotrwałe zwężenie naczyń i wzrost ciśnienia krwi;
Aldosteron stymuluje retencję sodu, co powoduje uwalnianie wazopresyny i zwiększone wchłanianie zwrotne wody;
Angiotensyna II powoduje również uczucie pragnienia, co zwiększa ilość płynów w organizmie
Zwiększenie objętości płynu i wzrost ciśnienia krwi usuwa bodziec, który spowodował aktywację układu renina-angiotensyna i wydzielanie aldosteronu, a w efekcie prowadzi do przywrócenia objętości krwi.
7. Spadek ciśnienia perfuzyjnego w kłębuszkach nerkowych może również wystąpić w wyniku zwężenia (zwężenia) tętnica nerkowa lub stwardnienie nerek. W tym przypadku włącza się także cały układ renina-angiotensyna. Ponieważ jednak początkowa objętość krwi i ciśnienie są w normie, włączenie systemu prowadzi do wzrostu ciśnienia krwi powyżej normy i rozwoju tzw. nadciśnienie nerkowe.
8. Hiperaldosteronizm - Jest to choroba spowodowana nadmiernym wydzielaniem aldosteronu przez nadnercza. Powód pierwotny hiperaldosteronizm (zespół Conna) jest gruczolakiem nadnercza lub rozlanym przerostem komórek strefy kłębuszkowej wytwarzających aldosteron. W pierwotnym hiperaldosteronizmie nadmiar aldosteronu zwiększa wchłanianie zwrotne sodu w kanalikach nerkowych. Wzrost stężenia Na+ w osoczu stymuluje wydzielanie hormonu antydiuretycznego i zatrzymywanie wody w nerkach. Ponadto wzmaga się wydalanie jonów potasu, magnezu i protonów. W rezultacie rozwija się hipernatremia, powodując w szczególności nadciśnienie, hiperwolemię i obrzęki; hipokaliemia prowadząca do osłabienia mięśni, a także niedoboru magnezu i zasadowicy metabolicznej. Powód wtórny hiperaldosteronizm jest podwyższony poziom reniny i angiotensyny II, co pobudza korę nadnerczy i prowadzi do nadmiernej syntezy aldosteronu. Objawy kliniczne są mniej wyraźne niż w przypadku pierwotnego aldosteronizmu. Jednoczesne oznaczenie stężenia aldosteronu i aktywności reniny w osoczu pozwala na jednoznaczne różnicowanie hiperaldosteronizmu pierwotnego (zmniejszenie aktywności reniny w osoczu) i wtórnego (zwiększenie aktywności reniny w osoczu).
9. Przedsionkowy czynnik natriuretyczny (ANF)- peptyd syntetyzowany i magazynowany jako prohormon w komórkach serca. Głównym czynnikiem regulującym wydzielanie PNP jest wzrost ciśnienia krwi. Głównymi komórkami docelowymi PNF są nerki, nadnercza i tętnice obwodowe. Receptor PNP błony komórkowej jest receptorem katalitycznym o aktywności cyklazy guanylanowej. W rezultacie
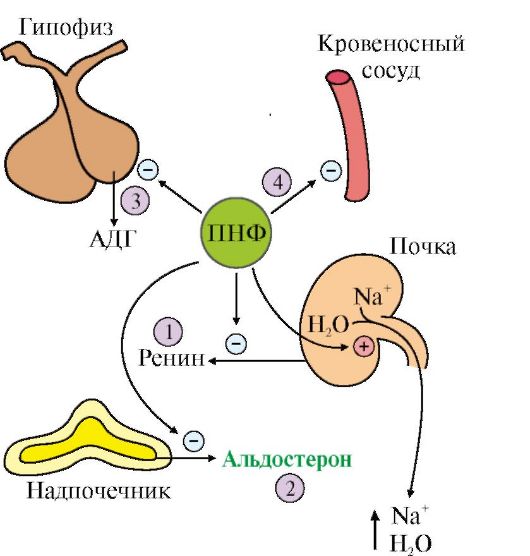 Ryż. 11.20. Efekty PNF:
Ryż. 11.20. Efekty PNF:
1 - hamuje uwalnianie reniny; 2 - hamuje wydzielanie aldosteronu; 3 - hamuje wydzielanie ADH; 4 - powoduje rozluźnienie naczyń
Kiedy PNP wiąże się z receptorem, aktywność cyklazy guanylanowej w receptorze wzrasta i z GTP tworzy się cykliczny GMP. W wyniku działania PNF dochodzi do zahamowania tworzenia i wydzielania reniny i aldosteronu. Efektem netto PNF jest zwiększenie wydalania Na+ i wody oraz obniżenie ciśnienia krwi (ryc. 11.20).
PNF jest ogólnie uważany za fizjologicznego antagonistę angiotensyny II, ponieważ powoduje rozszerzenie naczyń oraz utratę soli i wody.
TEMAT 11.9. REGULACJA METABOLIZMU WAPNIA I FOSFORANÓW. STRUKTURA, SYNTEZA I MECHANIZM DZIAŁANIA HORMONU PARATE, KALCYTRIOLU I KALCYTONINY
1. Organizm dorosłego człowieka zawiera -1,2 kg wapnia. Głównym źródłem wapnia w organizmie jest wapń kości (99% całego wapnia w organizmie). Kolejnym fundamentem są jony wapnia rozpuszczone w cieczach lub połączone z białkami płynów i tkanek. Stężenie wapnia wewnątrz komórek zależy od jego stężenia w płynie zewnątrzkomórkowym. Stężenie Ca 2 + we krwi osób zdrowych wynosi 2,12-2,6 mmol/l (9-11 mg/dl), w płynie wewnątrzkomórkowym jest tysiące razy mniejsze.
Wapń służy jako główny minerał element konstrukcyjny tkanka kostna. Jony wapnia biorą udział w skurczu mięśni, zwiększają przepuszczalność błony komórkowej dla jonów potasu, wpływają na przewodnictwo sodu w komórkach, działanie pomp jonowych, sprzyjają wydzielaniu hormonów, uczestniczą w kaskadowym mechanizmie krzepnięcia krwi, pełnią funkcję: najważniejszych pośredników w wewnątrzkomórkowej transmisji sygnału.
Stężenie Ca 2 + w osoczu jest regulowane z dużą precyzją: zmiana go zaledwie o 1% aktywuje mechanizmy homeostatyczne, które przywracają równowagę. Głównymi regulatorami metabolizmu Ca 2+ we krwi są parathormon, kalcytriol I kalcytonina.
2. Hormon przytarczyc zsyntetyzowane przytarczyc w postaci preprohormonu, który następnie w wyniku częściowej proteolizy przekształca się w dojrzały hormon. PTH jest wydzielany w odpowiedzi na obniżone stężenie wapnia we krwi. Głównymi narządami docelowymi dla tego hormonu są kości i nerki (ryc. 11.21).
Hormon inicjuje kaskadę zdarzeń związanych z cyklazą adenylanową osteoblastów, która stymuluje aktywność metaboliczną osteoklastów. Ca 2+ jest mobilizowany z kości, a fosforany przedostają się do krwi, a w dystalnych kanalikach nerek następuje stymulacja wchłaniania zwrotnego Ca 2+ i zmniejszanie wchłaniania zwrotnego fosforanów, co powoduje przywrócenie prawidłowego poziomu jonów wapnia w płynie zewnątrzkomórkowym .
3. kalcytriol, podobnie jak inne hormony steroidowe, jest syntetyzowany z cholesterolu. Bezpośrednim prekursorem kalcyferolu jest cholekalcyferol (witamina D3). Nie duża liczba zawiera witaminę D3
 Ryż. 11.21 Skutki PTH:
Ryż. 11.21 Skutki PTH:
1 - PTH stymuluje mobilizację wapnia z kości; 2 - PTH stymuluje wchłanianie zwrotne jonów wapnia w dystalnych kanalikach nerek; 3 - PTH aktywuje powstawanie 1,25(OH) 2 D 3 w nerkach, co prowadzi do stymulacji wchłaniania Ca 2 + w jelicie
w żywności, jednak większość witamin wykorzystywanych do syntezy kalcytriolu powstaje w skórze z 7-dehydrocholesterolu w reakcji nieenzymatycznej pod wpływem światła ultrafioletowego. Tworzenie kalcytriolu z witaminy D 3 rozpoczyna się w wątrobie, a kończy w nerkach (ryc. 11.22).
W wątrobie cholekalcyferol ulega hydroksylacji przy 25. atomie węgla, tworząc 25-hydroksycholekalcyferol. Hydroksylacja zachodząca w nerkach pod wpływem enzymu 1o-hydroksylazy jest etapem ograniczającym szybkość i prowadzi do powstania kalcytriolu 1,25(OH) 2 D 3 - aktywna forma witamina D3. Enzym tej reakcji jest aktywowany przez niskie stężenie jonów Ca 2 + we krwi i hormonie przytarczyc. Natomiast wzrost stężenia kalcytriolu hamuje syntezę 1o-hydroksylazy w nerkach, hamując powstawanie hormonu. Transportowany przez krew w kompleksie z białkiem nośnikowym, kalcytriol wiąże się z receptorem wewnątrzkomórkowym, oddziałuje z chromatyną i zmienia szybkość translacji. W rezultacie w komórkach docelowych syntetyzowane są białka, które zapewniają wchłanianie wapnia i fosforanów do enterocytów.
4. Kalcytonina - polipeptyd składający się z 32 reszt aminokwasowych z jednym wiązaniem dwusiarczkowym. Hormon jest wydzielany przez parafolikularne
 Ryż. 11.22 Schemat syntezy kalcytriolu:
Ryż. 11.22 Schemat syntezy kalcytriolu:
1 - cholesterol jest prekursorem kalcytriolu; 2 - w skórze 7-dehydrocholesterol pod wpływem promieniowania UV nieenzymatycznie przekształca się w cholekalcyferol; 3 - w wątrobie 25-hydroksylaza przekształca cholekalcyferol w kalcydiol; 4 - w nerkach powstawanie kalcytriolu jest katalizowane przez 1o-hydroksylazę
Komórki K tarczycy lub komórki C przytarczyc w postaci białka prekursorowego o dużej masie cząsteczkowej. Wydzielanie kalcytoniny wzrasta wraz ze wzrostem stężenia Ca 2 + i maleje wraz ze spadkiem stężenia Ca 2 + we krwi. Kalcytonina hamuje uwalnianie Ca 2+ z kości i stymuluje jego wydalanie przez nerki z moczem.
5. Hipokalcemia I hiperkalcemia, gdy stężenie wapnia w osoczu krwi jest niższe lub wyższe niż normalnie, wskazuje to na patologię. Zmiany poziomu wapnia we krwi wpływają na stężenie wapnia wewnątrz komórek, co prowadzi do zmiany progu pobudliwości komórek nerwowych i mięśniowych, zaburzenia pracy pompy wapniowej, zmniejszenia aktywności enzymów i zaburzenia regulacji hormonalnej metabolizmu. W przypadku hipokalcemii obserwuje się hiperodruchy, drgawki i skurcze krtani. W przypadku hiperkalcemii obserwuje się zmniejszenie pobudliwości nerwowo-mięśniowej i może wystąpić głębokie zaburzenie funkcji nerwowych, psychoza, otępienie i śpiączka.
6. Nadczynność przytarczyc. Nadmierne wydzielanie parathormonu, wynikające z guza przytarczyc, rozlanego rozrostu gruczołów, raka przytarczyc (pierwotna nadczynność przytarczyc), prowadzi do zwiększonej mobilizacji wapnia i fosforanów z kości, zwiększonego wchłaniania zwrotnego wapnia i wydalania fosforanów w nerkach. W efekcie dochodzi do hiperkalcemii, która może prowadzić do zmniejszenia pobudliwości nerwowo-mięśniowej i niedociśnienia mięśniowego. U pacjentów rozwija się ogólne osłabienie mięśni, zmęczenie i ból niektórych grup mięśni, wzrasta ryzyko złamań kręgosłupa, kości udowej i przedramienia. Wzrost stężenia jonów fosforanowych i wapnia w kanalikach nerkowych może powodować powstawanie kamieni nerkowych i prowadzić do hiperfosfaturii i hipofosfatemii.
7. Niedoczynność przytarczyc. Głównym objawem niedoczynności przytarczyc spowodowanej niewydolnością przytarczyc jest hipokalcemia. Spadek stężenia jonów wapnia we krwi może powodować zaburzenia neurologiczne, okulistyczne, sercowo-naczyniowe, a także uszkodzenia tkanki łącznej. U pacjenta z niedoczynnością przytarczyc dochodzi do wzmożonego przewodnictwa nerwowo-mięśniowego, napadów drgawek tonicznych, drgawek mięśni oddechowych i przepony oraz skurczu krtani.
8. Krzywica- choroba wieku dziecięcego związana z niedostateczną mineralizacją tkanki kostnej. Upośledzona mineralizacja kości jest następstwem niedoboru wapnia i może mieć następujące przyczyny: brak witaminy D 3 w diecie, upośledzone wchłanianie witaminy D 3 w jelicie cienkim, zmniejszona synteza prekursorów kalcytriolu na skutek niewystarczającego przebywania na słońcu , defekt Ια-hydroksylazy, defekt receptorów kalcytriolu w komórkach docelowych. Wszystko to powoduje zmniejszenie wchłaniania wapnia w jelitach i zmniejszenie jego stężenia we krwi, pobudzenie wydzielania hormonu przytarczyc, a w efekcie:
Jest to mobilizacja jonów wapnia z kości. W przypadku krzywicy dotknięte są kości czaszki, klatka piersiowa wraz z mostkiem wystaje do przodu, kości rurkowe i stawy rąk i nóg są zdeformowane, brzuch powiększa się i wystaje. Głównym sposobem zapobiegania krzywicy jest prawidłowe odżywianie i wystarczająca ekspozycja na słońce.
ZADANIA NA PRACĘ POZASZKOLNĄ
Rozwiązywać problemy
1. Zbadaj mechanizmy regulujące utrzymanie równowagi wodnej, pamiętaj o bodźcach powodujących wydzielanie hormonów i cechach mechanizmu ich działania (ryc. 11.19). Narysuj diagram sekwencji zdarzeń podczas przywracania równowagi wodno-solnej po spożyciu słonego pokarmu.
2. U 23-letniego mężczyzny podczas operacji usunięcia guza z górnej części przedniego płata przysadki mózgowej doszło do zajęcia cieśni tylnego płata przysadki mózgowej. W okresie pooperacyjnym u pacjenta rozwinęła się wielomocz. Jak można wytłumaczyć pojawienie się tego objawu u tego pacjenta? Aby uzasadnić odpowiedź:
a) wymienić hormony syntetyzowane w podwzgórzu i wydzielane z tylnego płata przysadki mózgowej;
b) narysuj schemat przekazywania sygnału tego hormonu do komórek docelowych;
c) nazwij działanie tego hormonu.
3. Zapamiętaj schemat syntezy hormonów steroidowych (ryc. 11.8) i zapisz w zeszycie kolejność etapów syntezy aldosteronu.
4. Stwórz własny diagram ilustrujący działanie aldosteronu i mechanizm jego działania.
5. Przeanalizuj schemat regulacji syntezy i wydzielania aldosteronu z udziałem układu renina-angiotensyna (ryc. 11.19) i wybierz brakujące składniki wskazane na schemacie (ryc. 11.23) liczbami.
6. Zrób własny diagram wyjaśniający główne skutki działania PNF (ryc. 11.20) i odpowiedz na pytanie, na czym opiera się działanie hipotensyjne
7. Wypełnij tabelę. 11.3.
Tabela 11.3. Charakterystyka hormonów regulujących gospodarkę wodno-solną
 Ryż. 11.23. Schemat regulacji homeostazy wodno-solnej
Ryż. 11.23. Schemat regulacji homeostazy wodno-solnej
8. Wypełnij tabelę. 11.4.
Tabela 11.4. Charakterystyka hormonów regulujących gospodarkę wapniowo-fosforanową
9. Korzystając ze schematu na ryc. 11.22, wskazać wszystkie możliwe przyczyny krzywicy i przedstawić schemat mechanizmu przekazywania sygnału kalcytriolu do komórek docelowych.
10. W przypadku hipowitaminozy D 3 proces mineralizacji kości zostaje zakłócony, zmniejsza się w nich zawartość wapnia i fosforanów; stężenie Ca 2 + we krwi utrzymuje się w normalnych granicach lub nieznacznie spada. Zrób schemat utrzymania homeostazy Ca 2 + w przypadku hipowitaminozy D 3 i określ:
a) z jakich źródeł jest wspierany? normalne stężenie W tym przypadku Ca 2+ we krwi;
b) jak będzie się zmieniać stężenie kalcytoniny i parathormonu we krwi.
11. Zwiększone wydalanie wapnia z moczem może powodować powstawanie kamieni nerkowych składających się głównie ze szczawianu wapnia. Wymień powody, dla których wydalanie Ca 2 może wzrosnąć.
ZADANIA SAMOKONTROLI
1. Wybierz poprawną odpowiedź.
W odpowiedzi na wzrost ciśnienia osmotycznego wzrasta synteza i wydzielanie hormonu:
A. Aldosteron B. Kortyzol
B. Wazopresyna G. Adrenalina D. Glukagon
2. Mecz.
Miejsce syntezy:
A. Wątroba B. Nerki
B. Podwzgórze G. Nadnercza
D. Trzustka
Metabolity:
1. Wazopresyna
2. Aldosteron
3. Mecz:
A. Bodźcem do syntezy i wydzielania jest powstawanie angiotensyny II B. Bodźcem do wydzielania jest wzrost stężenia jonów sodu
B. Narządy docelowe – tętnice obwodowe
D. Nadprodukcja hormonu prowadzi do wielomoczu. D. Miejsce syntezy – wątroba
1. Wazopresyna
2. Aldosteron
3. Angiotensynogen
4. Wybierz prawidłowe odpowiedzi. Angiotensyna II:
A. Powstaje w wątrobie
B. Jest enzymem proteolitycznym
B. Jest substratem reniny
D. Stymuluje syntezę aldosteronu. D. Stymuluje zwężenie naczyń
5. Wybierz prawidłowe odpowiedzi.
Kalcytriol:
A. Stymuluje wchłanianie zwrotne wapnia w nerkach
B. Jest prekursorem 7-dehydrocholesterolu
B. Stymuluje wchłanianie zwrotne sodu w nerkach
D. Zwiększa tempo wchłaniania wapnia w jelitach. D. Stymuluje mobilizację wapnia z kości
6. Wybierz prawidłowe odpowiedzi.
Zmniejszenie stężenia Ca 2 + w osoczu krwi powoduje:
A. Zwiększone wydzielanie parathormonu
B. Hamowanie aktywności komórek przypęcherzykowych tarczycy
B. Hydroksylacja metabolitów witaminy D 3 D. Zmniejszenie wydalania wapnia przez nerki
D. Zwiększenie szybkości resorpcji kości
7. Wykonaj zadanie „łańcuchowe”:
A) Hormon jest syntetyzowany w podwzgórzu:
A. Wazopresyna B. Adrenalina
B. Aldosteron G. Kalcytriol
B) Komórki docelowe dla tego hormonu to:
A. Komórki YUGA
B. Tętnice obwodowe
B. Komórki przewodów zbiorczych i kanalików dystalnych D. Komórki kłębuszków nefronowych
V) Wiążąc się z receptorami tych komórek, pobudza:
A. Układ cyklazy adenylanowej B. Fosfataza fosfoproteinowa
B. Układ trifosforanu inozytolu. D. Układ renina-angiotensyna.
G) w wyniku aktywacji tego układu zwiększa się ilość białka:
A. Albumina
B. Transportery sodu
B. Aquaporina-2
G. Transporter potasu
D) białko to zapewnia zwiększone wchłanianie zwrotne:
A. Jony potasu B. Jony wapnia
B. Jony sodu D. Woda
8. Wybierz prawidłowe odpowiedzi. Hormon przytarczyc:
A. Transportowany przez krew w połączeniu z białkiem nośnikowym B. Wydzielanie jest regulowane przez stężenie wapnia we krwi
B. Niedobór hormonów prowadzi do obniżonej koncentracji
D. Do przejawu aktywności biologicznej wymagana jest cała cząsteczka hormonu D. Zwiększa efektywność wchłaniania wody w jelicie
9. Wybierz prawidłowe odpowiedzi.
Wazopresyna:
A. Stymuluje wzrost ciśnienia osmotycznego osocza krwi B. Aktywuje kinazę białkową C w nerkach
B. Stymuluje wchłanianie zwrotne wody w nerkach
D. Obniża ciśnienie osmotyczne osocza krwi D. Stymuluje ekspresję genu akwaporyny-2
10. Mecz:
A. Wykazuje działanie zwężające naczynia B. Stymuluje wchłanianie zwrotne Na+
B. Oddziałuje z receptorami błonowymi komórek docelowych. D. Zwiększa wydzielanie reniny
D. Jest enzymem proteolitycznym
1. Aldosteron
2. Angiotensyna II
11. Wybierz wszystkie poprawne odpowiedzi. PNF:
A. Oddziałuje z receptorami błonowymi komórek docelowych B. Aktywuje fosfolipazę C
B. Aktywuje cyklazę guanylową
D. Hamuje wydzielanie aldosteronu. D. Zwiększa wydalanie wody i Na+
12. Mecz:
A. W nerkach B. W skórze
B. W wątrobie. D. W mózgu
D. W jelitach
1. Konwersja 7-dehydrocholesterolu w witaminę D 3 poprzez fotolizę nieenzymatyczną
2. Powstawanie 1,25 (OH)2D 3 w reakcji monooksygenazy z udziałem NADPH
3. Indukcja syntezy białek wiążących wapń STANDARDY ODPOWIEDZI NA „ZADANIA SAMOKONTROLI”
1. W 7. a) A, b) B, c) A, d) C, e) D
2. 1-B; 2-G; 3-B 8. PNE
3. 1-B; 2-A; 3-D 9. B, D, D
4. G, D 10. 1-B; 2-A; 3-D
5. A, G, D 11. A, B, D, D
6. A, B, D, D 12 .1 - B; 2 - B; 3 - D
PODSTAWOWE TERMINY I POJĘCIA
1. Homeostaza wodno-solna
2. moczówki prostej
3. Układ renina-angiotensyna-aldosteron
4. Hiperaldosteronizm
5. Hiperkalcemia
6. Hipokalcemia
7. Niedoczynność przytarczyc
8. Nadczynność przytarczyc
ZADANIA DO PRACY W KLASIE
Rozwiązywać problemy
1. Niektóre formy nadciśnienia powstają w wyniku różnych chorób nerek, na przykład gdy guz uciska tętnicę nerkową. Główną metodą leczenia w takich przypadkach jest usunięcie chorego narządu (nerki). Jednak poprawę stanu pacjentów obserwuje się, gdy pacjentom przepisuje się leki, które są Inhibitory ACE. Narysuj diagram przedstawiający zmianę metabolizmu wody i soli pod wpływem ucisku tętnicy nerkowej. W wyniku jakich zmian poprawia się stan pacjenta?
2. Pacjent zgłosił się do lekarza z dolegliwościami związanymi z częstym oddawaniem moczu i ciągłym uczuciem pragnienia. W trakcie badania stwierdzono zwiększenie dobowej objętości moczu przy gwałtownym spadku jego gęstości. Analiza wykazała, że poziom insuliny mieścił się w granicach normy, natomiast wykryto wzrost zawartości hormonu odpowiedzialnego za wchłanianie zwrotne wody. Zasugerować przyczynę wielomoczu u tego pacjenta? Aby odpowiedzieć na pytanie:
a) podaj nazwę tego hormonu;
b) wymienić bodźce powodujące jego wydzielanie;
c) wymienić rodzaje receptorów dla tego hormonu i ich lokalizację;
d) podać schemat przekazywania sygnału tego hormonu w nerkach;
e) opisać wpływ hormonu na tkanki docelowe;
f) podaj schemat regulacji wydzielania tego hormonu.
3. 48-letni mężczyzna zgłosił się do lekarza ze skargami na osłabienie, bóle mięśni, zaparcia oraz niedawne napady bólu pleców i podczas oddawania moczu. W trakcie badania u pacjentki rozpoznano pierwotną nadczynność przytarczyc, będącą konsekwencją rozwoju nadczynności tarczycy łagodny nowotwór lewy płat przytarczyc.
Wyjaśnij, dlaczego kamienie nerkowe mogą rozwijać się przy nadczynności przytarczyc? Rozwiązując zadanie skorzystaj ze schematów z zadania 5.
4. Do pediatry zgłosiła się kobieta ze skargą, że jej dwuletni synek stał się kapryśny, drażliwy i źle się odżywia. Pojawiło się pocenie, stolec był niestabilny. W badaniu stwierdzono elastyczność kości czaszki i deformacje klatki piersiowej. W biochemicznym badaniu krwi poziom wapnia całkowitego wynosi 1,57 mmol/l (normalnie 2,3-2,8 mmol/l). Zgadnij, na jaką chorobę cierpi to dziecko. Dla tego:
a) porównaj ilość całkowitego wapnia we krwi dziecka z normą, podaj nazwę tego stanu;
b) wskazać możliwe przyczyny, które mogą prowadzić do rozwoju tej choroby;
c) podać schemat syntezy hormonalnej regulacji metabolizmu wapnia;
d) wskazać mechanizm działania hormonów, przyczyny i skutki ich niedoboru w organizmie;
5. Przestudiuj diagram:
Przyczyny i skutki niedoczynności przytarczyc (ryc. 11.24). Zrób podobne diagramy dla:
a) nadczynność przytarczyc;
b) krzywica
 Ryż. 11.24. Przyczyny i skutki niedoczynności przytarczyc
Ryż. 11.24. Przyczyny i skutki niedoczynności przytarczyc
Dziękuję
Na stronie znajdują się informacje referencyjne wyłącznie w celach informacyjnych. Diagnozowanie i leczenie chorób musi odbywać się pod nadzorem specjalisty. Wszystkie leki mają przeciwwskazania. Wymagana konsultacja ze specjalistą!
Co to jest brak równowagi hormonalnej?
Gruczoły dokrewne Ludzkie ciało wyprodukować około 70 hormony. Normalny stosunek tych hormonów do siebie zapewnia stabilność procesów życiowych zdrowego organizmu. Ale gdy tylko produkcja przynajmniej jednego hormonu wzrośnie lub spadnie, zaburzenie hormonalne(rozbić się). Niewydolność hormonalna występuje szczególnie często u kobiet, gdy zaburzona jest synteza żeńskich hormonów płciowych.Oznaki braku równowagi hormonalnej w organizmie kobiety mogą być różne: przede wszystkim jest to naruszenie cyklu miesiączkowego. Ponadto zaburzenia hormonalne u kobiet mogą objawiać się:
- nadmierny lub niewystarczający wzrost włosów;
- niedorozwój gruczołów sutkowych;
- nagły przyrost masy ciała;
- nerwowość, drażliwość lub depresja;
- nadmierne pocenie;
- bóle głowy i wiele innych objawów.
Przyczyny braku równowagi hormonalnej u kobiet
Krucha równowaga hormonalna kobiet może zostać zakłócona przez wiele czynników:- złe nawyki (palenie, nadużywanie alkoholu);
- złe odżywianie;
- chroniczny brak snu;
- siedzący tryb życia lub wręcz przeciwnie, nadmierny ćwiczenia fizyczne;
- częste stosowanie hormonalnych środków antykoncepcyjnych;
- częste aborcje;
- przebyte infekcje (ARVI, zapalenie migdałków, rzeżączka, chlamydia, kiła itp.).
Metody leczenia zaburzeń hormonalnych
Oczywiście przede wszystkim zaburzenia równowagi hormonalnej leczy się lekami hormonalnymi. Jednak w większości przypadków poziom hormonów można przywrócić za pomocą nielekowych metod leczenia, które obejmują:- zdrowy tryb życia (wystarczająca ilość snu, aktywność fizyczna) świeże powietrze, poranny trening, odrzucenie złych nawyków);
- prawidłowe odżywianie (dieta z przewagą produktów roślinnych i tłuszczów roślinnych);
- ćwiczenia fizjoterapeutyczne;
- fizjoterapia, w tym masaż;
- balneoterapia (kąpiele z różnymi wodami mineralnymi);
- Leczenie uzdrowiskowe.
Odżywianie przy zaburzeniach hormonalnych
 Jeśli stan hormonalny jest zaburzony, kobiety muszą zmienić codzienną dietę, w tym w miarę możliwości pokarm roślinny– warzywa, owoce, jagody, grzyby. Faktem jest, że produkty te zawierają fitoestrogeny – substancje o właściwościach podobnych do żeńskich hormonów płciowych.
Jeśli stan hormonalny jest zaburzony, kobiety muszą zmienić codzienną dietę, w tym w miarę możliwości pokarm roślinny– warzywa, owoce, jagody, grzyby. Faktem jest, że produkty te zawierają fitoestrogeny – substancje o właściwościach podobnych do żeńskich hormonów płciowych. Fitoestrogeny występują w roślinach strączkowych (groch, fasola), ziarnach i kiełkach pszenicy oraz cebuli. Występują także w jajach (kurczaka, przepiórki itp.). Przykładowo omlet z cebulą i grzybami to danie typowo „damskie”, zawierające znaczną ilość fitoestrogenów.
W przypadku zaburzeń hormonalnych u kobiet, w celu normalizacji produkcji własnych hormonów przez organizm, potrzebne są produkty zawierające cynk i selen. Do takich produktów zalicza się chude mięso (wołowina), smalec, płatki owsiane, mleko, wszystkie warzywa liściaste (sałata, kapusta, koper, natka pietruszki, szpinak, bazylia, rzeżucha itp.), orzechy (orzeszki ziemne, migdały, pistacje), nasiona dyni, czosnek .
Zaleca się wykluczenie (lub ograniczenie do minimum) produktów spożywczych takich jak cukier, miód, pieczywo, słodycze, czekolada, mleko skondensowane, ziemniaki, mięso (wieprzowina, gęś, kaczka), konserwy, wędliny.
Jeśli brak równowagi hormonalnej doprowadził do gwałtownego wzrostu masy ciała, utratę wagi osiąga się za pomocą diety hormonalnej (metabolicznej).
Dieta hormonalna
Dieta ta aktywuje syntezę hormonów sprzyjających spalaniu tłuszczu (testosteron, adrenalina, noradrenalina) oraz hamuje produkcję hormonów powodujących gromadzenie się tłuszczu w organizmie (insulina, estrogeny).Fazy diety hormonalnej:
1.
Szybkie i aktywne spalanie tkanki tłuszczowej (około 2 tygodni).
2.
Stabilny poziom spalania tkanki tłuszczowej (czas nieokreślony).
3.
Utrzymanie wagi na osiągniętym niskim poziomie.
Aby ułatwić przygotowanie codziennego menu na różnych etapach diety hormonalnej, wszystkie produkty spożywcze podzielono na 5 grup różne kwoty zwrotnica. Im wyższy wynik, tym silniejsze odkładanie się tłuszczu podczas spożywania tego produktu. I odwrotnie: produkty zaliczone do grupy „0 punktów” nie przyczyniają się do odkładania tkanki tłuszczowej, lecz do jej spalania.
| Zwrotnica | Żywność |
| 0 | Jajka, ryby, krewetki, kalmary, małże, królik, kurczak (białe mięso z piersi), indyk (białe mięso z piersi), grzyby, warzywa, limonka, cytryna, koper, pietruszka, musztarda, chrzan, zielony groszek, nabiał z zawartością tłuszczu nie więcej niż 2%. |
| 1 | Jagody, fasola, świeżo wyciskane soki warzywne. |
| 2 | Kurczak, wołowina, cielęcina, oleje roślinne, orzechy (orzechy włoskie, orzechy laskowe, pistacje), pieczywo z otrębów, gotowana marchew i buraki, owoce, oliwki czarne, ser feta, ser feta, ryż brązowy, płatki owsiane, kasza gryczana, nabiał bez zawartości tłuszczu ponad 4%. |
| 3 | Dowolne sery, kasza jaglana, jogurty z dodatkami, gorzka czekolada, musli, świeżo wyciskane soki owocowe. |
| 4 | Wieprzowina, kaczka, gęś, kiełbasa, parówki, ziemniaki, cukier, miód, suszone owoce, wypieki, czekolada mleczna, słodycze, lody, Kasza manna, konserwy w oleju, produkty mleczne o zawartości tłuszczu powyżej 4%. |
Stosując dietę hormonalną, należy jej przestrzegać następujące zasady na każdym jego etapie:
1.
Jednorazowo można zjeść nie więcej niż 250-300 ml jedzenia (objętość nieco większa niż 1 szklanka), czy to obiad, śniadanie czy kolacja.
2.
Pomiędzy posiłkami nie powinno upłynąć więcej niż trzy godziny.
3.
Pamiętaj, aby pić 2 (lub więcej) litry wody dziennie.
Rozkład posiłków wygląda mniej więcej tak:
- Śniadanie – nie później niż o godzinie 10.00;
- II śniadanie – najpóźniej do godz. 12.00;
- Obiad – nie później niż o godzinie 15.00;
- Podwieczorek – nie później niż o 18.00;
- Kolacja – nie później niż o godzinie 20.00.
Odżywianie w I fazie diety hormonalnej musi być bardzo skąpe. Możesz jeść tylko produkty, które zawierają 0 punktów. Oliwa z oliwek jest dozwolona w ilości 1 łyżki dziennie.
Jednocześnie waga szybko spada, dlatego należy uważnie monitorować swoje samopoczucie. Jeśli nagle pojawi się osłabienie, ciemnienie oczu lub szum w uszach, należy natychmiast wypić mocną słodką herbatę i położyć się. Takie objawy są sygnałem, że należy przejść do II fazy diety hormonalnej. W każdym razie czas trwania pierwszej fazy nie przekracza dwóch tygodni.
Odżywianie w II fazie diety hormonalnej przebiega według następującego schematu:
- Śniadanie – 4 punkty;
- II śniadanie – 2 punkty;
- Obiad – 2 punkty;
- Podwieczorek – 1 punkt;
- Kolacja – 0 punktów.
Przykładowo wybierz 1 produkt z listy 3-punktowej + 1 produkt z listy 1-punktowej + dowolną liczbę produktów 0-punktowych (pamiętaj o ograniczonej łącznej objętości!).
Lub: 1 produkt wart 4 punkty + kilka produktów za 0 punktów.
Lub: 2 produkty z listy 2-punktowej.
Potrawy do każdego posiłku dobierane są w ten sam sposób. Całkowity punktów może być mniejsza niż zalecana, ale w żadnym wypadku większa. W przypadku pominięcia jednego posiłku jego punkty nie sumują się do następnego posiłku.
II faza diety hormonalnej nie ma ograniczeń czasowych. Waga spada stopniowo i równomiernie. Kiedy osiągniesz pożądany efekt, przejdź do fazy 3.
Odżywianie w III fazie diety hormonalnej przeprowadzone w następujący sposób: wybierz jeden posiłek (na przykład obiad) i dodaj do niego 1 punkt. Kontroluj swoją wagę. Jeśli utrata masy ciała będzie się utrzymywać, możesz dodać 1 punkt do innego posiłku. Dodawanie punktów trwa aż do ustania utraty wagi.
Dieta hormonalna hCG
 Istnieje jeszcze jedna dieta na odchudzanie, zwana także hormonalną, jednak efekty jej stosowania są bardzo wątpliwe. Dieta ta polega na tym, że w diecie stosuje się wyłącznie niskokaloryczne pokarmy, a kobieta jednocześnie otrzymuje zastrzyki z hormonu hCG (ludzka gonadotropina kosmówkowa). Zwykle hormon ten jest syntetyzowany w organizmie kobiety w czasie ciąży.
Istnieje jeszcze jedna dieta na odchudzanie, zwana także hormonalną, jednak efekty jej stosowania są bardzo wątpliwe. Dieta ta polega na tym, że w diecie stosuje się wyłącznie niskokaloryczne pokarmy, a kobieta jednocześnie otrzymuje zastrzyki z hormonu hCG (ludzka gonadotropina kosmówkowa). Zwykle hormon ten jest syntetyzowany w organizmie kobiety w czasie ciąży. Nie ma przekonujących dowodów na skuteczność tej diety, a wprowadzenie hormonu hCG może prowadzić do nieprzewidywalnych rezultatów. Istnieje duże prawdopodobieństwo wystąpienia jeszcze poważniejszych zaburzeń hormonalnych. Dlatego medycyna naukowa kategorycznie sprzeciwia się stosowaniu tej diety.
Ziołolecznictwo na zaburzenia hormonalne
Zioła lecznicze mogą pomóc skorygować brak równowagi hormonalnej. W medycynie ludowej wykorzystuje się w tym celu napary i nalewki z następujących roślin:- goździk polny;
- oregano („zioło żeńskie”);
- miodunka;
- pięciornik gęsi;
- może pokrzywa;
- kwiaty lipy;
- nasiona lnu itp.
Napary najczęściej przygotowuje się według standardowego schematu (łyżka ziół na szklankę wrzącej wody, pozostawić do ostygnięcia). W przypadku zaburzeń hormonalnych u kobiet zaleca się pić napar z goździków polnych w ten sposób przez dwa tygodnie, 4 razy dziennie, po 1/4 szklanki.
Kiedy dochodzi do braku równowagi hormonalnej, często rozwija się brak miesiączki (brak miesiączki). W tym przypadku etnonauka zaleca stosowanie cebuli lub jej skórek:
- Szklankę skórki cebuli wlać do 0,5 litra wrzącej wody, gotować przez 20 minut, ostudzić, przefiltrować i przyjmować łyżkę stołową trzy razy dziennie (przed posiłkami).
- Weź 5 głów cebuleśredniej wielkości i 3-4 ząbki czosnku. Obierz, rozgnieć i zalej trzema szklankami mleka. Doprowadź mieszaninę cebuli i czosnku do miękkości na małym ogniu. Następnie zdjąć z ognia, lekko ostudzić i wymieszać z trzema łyżeczkami miodu. Mieszankę przyjmuje się 3 razy dziennie, po łyżce stołowej, aż do wyczerpania się leku (należy przechowywać go w lodówce).
Fizjoterapia w zaburzeniach hormonalnych
 Metody fizjoterapii są często stosowane w leczeniu zaburzeń hormonalnych u kobiet. Metody te, bez stosowania leków, pozwalają uregulować zaburzony cykl menstruacyjny, wyleczyć dysfunkcję jajników, brak miesiączki i inne procesy patologiczne w organizmie kobiety związane z brakiem równowagi hormonalnej. Ponadto metody leczenia fizjoterapeutycznego zwiększają odporność i ogólną odporność organizmu na szkodliwe czynniki środowiskowe.
Metody fizjoterapii są często stosowane w leczeniu zaburzeń hormonalnych u kobiet. Metody te, bez stosowania leków, pozwalają uregulować zaburzony cykl menstruacyjny, wyleczyć dysfunkcję jajników, brak miesiączki i inne procesy patologiczne w organizmie kobiety związane z brakiem równowagi hormonalnej. Ponadto metody leczenia fizjoterapeutycznego zwiększają odporność i ogólną odporność organizmu na szkodliwe czynniki środowiskowe. W przypadku zaburzeń hormonalnych u kobiet najskuteczniejsze są następujące metody fizjoterapii:
- elektryczna stymulacja szyjki macicy;
- akupunktura;
- laseroterapia (w tym ILBI);
- elektroforeza strefy kołnierza za pomocą nowokainy;
- galwanizacja mózgu;
- masaże (ogólne i ginekologiczne);
- hirudoterapii (leczenie pijawkami).
Leczenie pijawkami – hirudoterapia – jest skuteczne na każdego patologia hormonalna, w tym w przypadku zaburzeń równowagi hormonalnej u kobiet. Ślina pijawek zawiera substancje stymulujące produkcję hormonów, których organizmowi brakuje. Aby skorygować równowagę hormonalną, pijawki umieszcza się zwykle w okolicy krzyżowo-guzicznej. Umieszczenie pijawek w tym miejscu nie tylko przywraca zaburzoną równowagę hormonalną, ale także pobudza organizm do oczyszczania się z toksyn.
Laseroterapię zaburzeń hormonalnych u kobiet stosuje się w formie naświetlania narządów wewnętrznych (przez ścianę brzucha lub przez pochwę) oraz w formie dożylnego naświetlania laserowego krwi.
Działanie promienia lasera na narządy wewnętrzne jest całkowicie bezbolesne, nie powoduje skutków ubocznych i zapewnia długotrwały efekt zabiegu.
ILBI to uniwersalna metoda leczenia, bezpieczna i wysoce skuteczna. Napromienianie dożylne zabieg krwi laserem o niskiej częstotliwości delikatnie oddziałuje na organizm, stymulując układ samoregulacji i zapewniając korekcję zaburzeń hormonalnych. ILBI można stosować samodzielnie lub w ramach kompleksowego leczenia.
Korekta stanu psychicznego w przypadku zaburzeń hormonalnych
 W niektórych przypadkach zdrowie psychiczne Pacjenci z zaburzeniami równowagi hormonalnej cierpią tak bardzo, że wymagają specjalnej korekty. Zaburzenia psychoemocjonalne są szczególnie częste, gdy
W niektórych przypadkach zdrowie psychiczne Pacjenci z zaburzeniami równowagi hormonalnej cierpią tak bardzo, że wymagają specjalnej korekty. Zaburzenia psychoemocjonalne są szczególnie częste, gdy Hormonalne badania krwi nie są badaniami obowiązkowymi. Najczęściej takie skierowanie wydawane jest w przypadku podejrzenia rozwoju jakiejkolwiek patologii endokrynologicznej. Z reguły przeprowadza się badania krwi na obecność hormonów w celu wyjaśnienia lub potwierdzenia diagnozy. Po wykonaniu testowane laboratoryjnie Określa się stopień produkcji hormonów i na podstawie tych badań przepisuje się leczenie.
Wykonanie badania krwi na hormony podwzgórza i przysadki mózgowej
Jeśli podejrzewa się pewne choroby układu nerwowego, przepisuje się badania na hormony układu podwzgórzowo-przysadkowego.
Ścisły związek między układem nerwowym i hormonalnym wynika z anatomicznego i funkcjonalnego połączenia przysadki mózgowej i podwzgórza oraz gruczoły obwodowe wydzielanie.
Podwzgórze- najwyższy ośrodek wegetatywny, koordynujący funkcje niemal wszystkich układów organizmu poprzez uwalnianie hormonów stymulujących (hormony uwalniające) i blokujących (hormony hamujące), które będą regulować produkcję hormonów przysadkowych oddziałujących na gruczoły obwodowe wydzielina wewnętrzna(tarczyca i przytarczyce, nadnercza, jajniki u kobiet, jądra u mężczyzn, trzustka itp.).
Wykonuje się badania laboratoryjne następujących hormonów podwzgórza:
- hormon uwalniający kortykotropinę (CRH);
- hormon uwalniający tyreotropinę (TRH);
- hormon uwalniający gonadotropinę (GHR);
- hormon uwalniający prolaktynę (PRH);
- hormon uwalniający somatotropinę (STRG);
- hormon uwalniający melanotropinę (MRH);
- hormon hamujący uwalniający gonadotropinę (GRIG);
- hormon hamujący uwalniający prolaktynę (PRIG);
- somatostatyna;
- melanostatyna.
Przysadka mózgowa jest anatomicznie i funkcjonalnie podzielona na trzy strefy: płat przedni (gruczołowo-przysadkowy) - miejsce syntezy większości hormonów regulujących czynność funkcjonalną obwodowych gruczołów dokrewnych, płat pośredni i tylny. Najbardziej rozpowszechnioną wartością diagnostyczną jest badanie poziomu hormonów w płacie przednim.
Hormony przedniego płata przysadki mózgowej:
- hormon adrenokortykotropowy (ACTH);
- hormon wzrostu (GH) lub hormon wzrostu;
- hormon stymulujący tarczycę (TSH);
- hormon folikulotropowy (FSH);
- hormon luteinizujący (LH);
- prolaktyna (PRL).
Hormony tylnego płata przysadki mózgowej:
- hormon antydiuretyczny (ADH);
- oksytocyna.
Wydzielanie hormonów przysadki jest regulowane przez mechanizm regulacji nerwowej i zasadę sprzężenia zwrotnego. Kiedy zostaje zakłócona relacja między podwzgórzem, przysadką mózgową i obwodowymi gruczołami dokrewnymi, powstają stany patologiczne, a niedobory wydzielania hormonów przysadki są często wielorakie, ale nadmierne wydzielanie jest zwykle charakterystyczne dla jednego hormonu.
Tabela „Stany patologiczne upośledzonego wydzielania hormonów gruczolakowatych”:
|
Zwiększona aktywność |
Zmniejszona aktywność |
|
1. Wczesna diagnostyka miażdżycy |
1. Przyjmowanie estrogenów i kwasów tłuszczowych omega-3 |
|
2. Zwężenie naczyń mózgowych |
2. Surowi wegetarianie |
|
3. Ostry zawał mięśnia sercowego mięsień sercowy, |
|
|
4. Niedoczynność tarczycy |
|
|
5. Przewlekła niewydolność nerek |
|
|
6. Choroby wątroby |
|
|
7. Palenie |
|
|
8. Ciąża |
|
|
9. Intensywna aktywność fizyczna |
|
|
10. Infekcje i stany zapalne |
Badania laboratoryjne hormonów ACTH i STH
Hormon adrenokortykotropowy (ACTH) to hormon regulujący czynność kory nadnerczy. Wydzielanie ACTH podlega dobowym wahaniom – maksymalne stężenie hormonu we krwi obserwuje się we wczesnych godzinach porannych (około 6-8), minimalne wynosi około 22 godzin.
Referencyjna zawartość hormonu adrenokortykotropowego w surowicy krwi wynosi poniżej 46 pg/ml.
Hormon somatotropowy (STH)- jest to hormon stymulujący syntezę białek, podział komórek i wzmagający rozkład tłuszczów; Główną funkcją jest stymulacja wzrostu organizmu. Wydzielanie hormonu wzrostu przebiega nierównomiernie – około 5-9 uwolnień hormonu wzrostu dziennie, przez resztę czasu jego poziom jest niski. Ten charakter przyjęcia utrudnia ocenę badania początkowego stanu hormonalnego we krwi, czasami wymagając zastosowania specjalnych testów prowokacyjnych.
Tabela „Normy badań hormonalnych zawartości hormonów somatotropowych u kobiet w surowicy krwi”:
Robię badania hormonalne na TSH
Hormon tyreotropowy (TSH)- hormon stymulujący produkcję hormonów tarczycy - T3 i T4. Wykonywanie badań w celu oznaczenia hormonu tyreotropowego jest szczególnie istotne w przypadku łagodnych postaci dysfunkcji tarczycy, gdy stężenie T3 i T4 mieści się w granicach normy, a także gdy monitorowanie terapeutyczne pacjenci otrzymujący Terapia zastępcza tyroksyna.
Tabela „Wartości referencyjne wyników badań hormonu tyreotropowego w surowicy krwi”:
 Przeciwciała receptorowe hormonu tyreotropowego (anty-rTSH) to przeciwciała wiążące się z receptorami TSH. Ze względu na działanie dzieli się je na dwie grupy: przeciwciała stymulujące i blokujące. Stymulanty anty-rTSH zwiększają czynność tarczycy, co może prowadzić do wole rozproszone i nadczynność tarczycy.
Przeciwciała receptorowe hormonu tyreotropowego (anty-rTSH) to przeciwciała wiążące się z receptorami TSH. Ze względu na działanie dzieli się je na dwie grupy: przeciwciała stymulujące i blokujące. Stymulanty anty-rTSH zwiększają czynność tarczycy, co może prowadzić do wole rozproszone i nadczynność tarczycy.
Blokery anty-rTSH zmniejszają biologiczne działanie TSH i prowadzą do zaniku i niedoczynności tarczycy. Anty-rTSH to immunoglobuliny klasy IgG, dzięki czemu mogą przenikać przez barierę płodowo-łożyskową. Przeciwciała przeciwko receptorowi hormonu tyreotropowego (anty-TSH) to przeciwciała, które wiążą się z receptorami TSH. Ze względu na działanie dzieli się je na dwie grupy: przeciwciała stymulujące i blokujące. Stymulujące anty-rTSH poprawiają czynność tarczycy, co może prowadzić do wola rozlanego i nadczynności tarczycy.
Blokery anty-rTSH zmniejszają biologiczne działanie TSH i prowadzą do zaniku i niedoczynności tarczycy. Anty-rTSH to immunoglobuliny klasy IgG, dzięki czemu mogą przenikać przez barierę płodowo-łożyskową.
Tabela „Normy dotyczące hormonalnych badań krwi na obecność anty-rTSH w surowicy krwi”:
Ogólna analiza hormonalna dla FSH i LH
 Hormon folikulotropowy (FSH) reguluje rozwój, wzrost, dojrzewanie płciowe i procesy rozrodcze w organizmie człowieka. Jego ilość we krwi przed okresem dojrzewania jest dość niska, a w tym okresie gwałtownie wzrasta. U kobiety FSH kontroluje wzrost pęcherzyków w jajniku, aż osiągną dojrzałość i będą gotowe do owulacji – uwolnienia komórki jajowej. FSH wraz z hormonem luteinizującym stymuluje syntezę hormonu płciowego – estradiolu.
Hormon folikulotropowy (FSH) reguluje rozwój, wzrost, dojrzewanie płciowe i procesy rozrodcze w organizmie człowieka. Jego ilość we krwi przed okresem dojrzewania jest dość niska, a w tym okresie gwałtownie wzrasta. U kobiety FSH kontroluje wzrost pęcherzyków w jajniku, aż osiągną dojrzałość i będą gotowe do owulacji – uwolnienia komórki jajowej. FSH wraz z hormonem luteinizującym stymuluje syntezę hormonu płciowego – estradiolu.
Wśród kobiet wiek rozrodczy Poziom FSH zmienia się w zależności od fazy cyklu miesiączkowego – w pierwszej fazie (pęcherzykowej) następuje stopniowy wzrost zawartości FSH, maksymalne stężenie obserwuje się w połowie cyklu (okres owulacji) w trzeciej fazie (lutealnej) kwota maleje.
W okresie menopauzy poziom hormonów pozostaje stale wyższy. U mężczyzn FSH odpowiada za funkcjonowanie kanalików nasiennych, a spermatogeneza to proces powstawania plemników.
Tabela „Wartości referencyjne ogólnej analizy hormonalnej hormonu folikulotropowego u mężczyzn w surowicy krwi”:
Tabela „Wyniki referencyjne badań hormonalnych hormonu folikulotropowego u kobiet w surowicy krwi”:
W organizmie kobiety hormon luteinizujący (LH) stymuluje owulację i aktywuje syntezę estrogenu i progesteronu w komórkach jajników. U mężczyzn hormon ten stymuluje syntezę testosteronu. Poziom LH w surowicy krwi u kobiet w wieku rozrodczym charakteryzuje się wahaniami odpowiadającymi poszczególnym fazom cyklu miesiączkowego. Wykonując laboratoryjne badania hormonów należy wziąć pod uwagę, że przez niemal cały cykl stężenie LH pozostaje niskie, z wyjątkiem wzrostu w połowie cyklu.
Jak przygotować się do badania krwi na hormon prolaktynę
 U kobiet w wieku rozrodczym prolaktyna wraz z estradiolem wpływa na wzrost i funkcjonowanie gruczołów sutkowych oraz odpowiada za laktację. U mężczyzn działanie tego hormonu polega na regulacji spermatogenezy i stymulacji wytwarzania wydzieliny prostaty.
U kobiet w wieku rozrodczym prolaktyna wraz z estradiolem wpływa na wzrost i funkcjonowanie gruczołów sutkowych oraz odpowiada za laktację. U mężczyzn działanie tego hormonu polega na regulacji spermatogenezy i stymulacji wytwarzania wydzieliny prostaty.
W organizmie kobiety poziom prolaktyny zależy od fazy cyklu miesiączkowego, w czasie ciąży i karmienia piersią wzrasta zawartość prolaktyny we krwi.
Prolaktyna nazywana jest także „hormonem stresu”, gdyż wzrost jej poziomu obserwuje się pod wpływem różnego rodzaju stresu fizycznego i emocjonalnego.
Przepisując oznaczenie poziomu prolaktyny w surowicy krwi, pacjent musi przestrzegać następujących zasad w ramach przygotowań do analizy tego hormonu:
- Badanie przeprowadza się rano, 2-3 godziny po przebudzeniu.
- Przed wykonaniem badania krwi na hormon prolaktynę należy w przeddzień i w dniu badania wykluczyć aktywność fizyczną i stany przegrzania (wizyta w łaźni, saunie itp.).
- Przed badaniem wskazane jest spędzenie 30 minut w stanie odpoczynku fizycznego i psycho-emocjonalnego.
- U kobiet hormon określa się w pierwszych trzech dniach cyklu miesiączkowego.
- Przed wykonaniem badania krwi na obecność hormonów należy unikać palenia.
- Dzień wcześniej należy unikać spożywania alkoholu (nawet w minimalnych dawkach).
Referencyjne wyniki hormonalnych badań krwi na obecność prolaktyny w surowicy krwi:
- U mężczyzn – 72-229 miodu/l.
- U kobiet po okresie dojrzewania i przed menopauzą – 79-347 mU/l.
Hormony tarczycy, tyroksyna i trójjodotyronina
 Tarczyca człowieka jest największym gruczołem wydzielania wewnętrznego w organizmie, jej aktywność jest regulowana przez przedni płat przysadki mózgowej – centralny aparat wydzielania wewnętrznego znajdujący się w mózgu, poprzez produkcję hormonu tyreotropowego (TSH), tworzenie która z kolei jest stymulowana przez wydzielaną przez mózg tereoliberynę - podwzgórze.
Tarczyca człowieka jest największym gruczołem wydzielania wewnętrznego w organizmie, jej aktywność jest regulowana przez przedni płat przysadki mózgowej – centralny aparat wydzielania wewnętrznego znajdujący się w mózgu, poprzez produkcję hormonu tyreotropowego (TSH), tworzenie która z kolei jest stymulowana przez wydzielaną przez mózg tereoliberynę - podwzgórze.
Jeden rodzaj komórek tarczycy wytwarza tyroksynę (T4) i trójjodotyroninę (T3) – hormony, których głównym działaniem jest regulacja i utrzymanie podstawowej przemiany materii, przemiany białek, tłuszczów i węglowodanów, regulacja czynności układu oddechowego, czyli tzw. prawidłowy poziom hormonów jest niezbędny do prawidłowego funkcjonowania niemal wszystkich układów organizmu człowieka, a gdy zmienia się on w górę lub w dół, pojawiają się problemy zmiany patologiczne charakter polisystemowy.
Zwiększone wydzielanie hormonów tarczycy prowadzi do procesów katabolizmu (rozkładu) białek, tłuszczów i węglowodanów, co objawia się postępującą utratą masy ciała na tle wzmożonego apetytu, utrzymującymi się zaburzeniami układu sercowo-naczyniowego (szybkie bicie serca, podwyższone ciśnienie krwi, duszność). oddech), układ nerwowy (drażliwość, agresywność, ustępowanie płaczliwości, apatia) i szereg innych układów.
Wraz ze spadkiem tworzenia hormonów tarczycy obserwuje się zaburzenia wielonarządowe przewodu pokarmowego, układu sercowo-naczyniowego, nerwowego i rozrodczego, skóry i układu mięśniowo-szkieletowego.
Do tworzenia hormonów tarczycy niezbędny jest jod pochodzący z pożywienia oraz aminokwas tyrozyna, który jest syntetyzowany w organizmie człowieka i pochodzi z pożywienia (banany, awokado, migdały, produkty mleczne). Dlatego w odniesieniu do prawidłowego funkcjonowania tarczycy bardzo ważne jest zachowanie równowagi i dobre odżywianie. Pobudzający wpływ TSH na komórki tarczycy aktywuje biosyntezę T4 i T3, które występują we krwi zarówno w postaci wolnej, jak i związanej ze specyficznym białkiem – globuliną wiążącą tyroksynę.
Cechą hormonów tarczycy jest ich dobowy i sezonowy cykl dobowy - maksymalny poziom obserwuje się w godzinach porannych (od 8 do 12), minimalny - od 23 do 3 rano; przez cały rok, maksymalne stężenie obserwuje się w okresie od września do lutego, a minimalne w miesiącach letnich. Poziom hormonów u zdrowych dorosłych pozostaje względnie stały do około 40-45 roku życia, po czym może nieznacznie spaść.
Zasady przygotowania do badania hormonów tarczycy
 Wielonarządowy charakter zmian w przypadku zaburzeń prawidłowego funkcjonowania tarczycy sprawia, że laboratoryjne badanie poziomu hormonów tarczycy ma duże znaczenie diagnostyczne. Ponieważ na te wskaźniki wpływa wiele czynników przedanalitycznych, bardzo ważne jest prawidłowe wyjaśnienie pacjentowi, jak się przygotować. Przepisując badanie hormonalne tarczycy w surowicy krwi, pacjent musi przestrzegać następujących zasad:
Wielonarządowy charakter zmian w przypadku zaburzeń prawidłowego funkcjonowania tarczycy sprawia, że laboratoryjne badanie poziomu hormonów tarczycy ma duże znaczenie diagnostyczne. Ponieważ na te wskaźniki wpływa wiele czynników przedanalitycznych, bardzo ważne jest prawidłowe wyjaśnienie pacjentowi, jak się przygotować. Przepisując badanie hormonalne tarczycy w surowicy krwi, pacjent musi przestrzegać następujących zasad:
- Badanie przeprowadza się wyłącznie na czczo (ostatni posiłek 10-12 godzin przed analizą).
- Badanie przeprowadza się rano (od 8 do 10 rano).
- Należy wykluczyć aktywność fizyczną, stany hipotermii i przegrzania dzień przed i w dniu badania (wskazane jest, aby co najmniej 30 minut przed analizą znajdować się w stanie odpoczynku fizycznego i psycho-emocjonalnego).
- Przed wykonaniem badań hormonalnych należy dzień wcześniej nie pić alkoholu i nie palić.
- Na definicja pierwotna na miesiąc przed badaniem należy wykluczyć leki zawierające jod i wpływające na pracę tarczycy.
- Monitorując terapię, należy wykluczyć stosowanie leków hormonalnych w dniu hormonalnego badania krwi i koniecznie zanotować w formularzu analizy.
- Na kilka dni przed badaniem poziomu hormonów we krwi należy unikać przyjmowania leków takich jak aspiryna, środki uspokajające, kortykosteroidy i doustne środki antykoncepcyjne. Jeśli odstawienie tych leków nie jest możliwe, wówczas ta informacja wskazać w formularzu analizy.
Ocena stanu hormonalnego tarczycy po badaniu pozwala wyróżnić trzy stany funkcjonalne: nadczynność, niedoczynność, eutyreozę, gdy poziom hormonów mieści się w granicach normatywnych.
Badanie krwi na hormon tarczycy T4: normy i przyczyny zmian
Tyroksyna (T4) to jeden z dwóch głównych hormonów tarczycy, którego główną funkcją jest regulacja metabolizmu energetycznego i plastycznego w organizmie. Całkowita tyroksyna jest sumą dwóch frakcji: związanego z białkami i niezwiązanego z białkami osocza krwi (wolny T4).
Tabela „Wartości referencyjne do badania hormonu tarczycy T4”:
Tabela „Wartości referencyjne do analizy hormonów tarczycy, wolnej tyroksyny (z T4)”:
Tabela „Patologiczne i przyczyny fizjologiczne zmiany stężenia tyroksyny całkowitej (T4) i wolnej tyroksyny (wraz z T4) w surowicy krwi ludzkiej”:
Analiza hormonalna tarczycy: normy T3 i przyczyny zmian
Trójjodotyronina (T3)- jeden z dwóch głównych hormonów tarczycy, którego główną funkcją jest regulacja gospodarki energetycznej (głównie wchłaniania tlenu przez tkanki) i metabolizmu plastycznego w organizmie.
Całkowita trójjodotyronina jest sumą dwóch frakcji: osocza krwi związanego z białkami i niezwiązanego z białkami.
Tabela „Wartości referencyjne dla badań krwi na hormon tarczycy T3”:
Wolna trójjodotyronina nie wiąże się biologicznie z białkami osocza krwi. aktywni uczestnicy trójjodotyronina (hormon tarczycy), która reguluje tempo podstawowej przemiany materii, wzrost tkanek, metabolizm białek, węglowodanów, lipidów i wapnia, a także pracę układu sercowo-naczyniowego, trawiennego, oddechowego, rozrodczego i nerwowego.
Wartości referencyjne dla analizy hormonalnej tarczycy dla wolnej trójjodotyroniny wynoszą 2,6 -5,7 pmol/l.
Tabela „Patologiczne i fizjologiczne przyczyny zmian stężenia trójjodotyroniny całkowitej (T3) i wolnej trójjodotyroniny (z T3) w surowicy ludzkiej”:
Enzym tarczycowy, peroksydaza tarczycowa, odgrywa kluczową rolę w tworzeniu hormonów tarczycy. Peroksydaza tarczycowa bierze udział w tworzeniu aktywnej formy jodu, bez której niemożliwa jest biochemiczna synteza hormonów tarczycy T4 i T3.
Przeciwciała przeciwko peroksydazie tarczycowej
 Przeciwciała przeciwko peroksydazie tarczycowej- specyficzne immunoglobuliny skierowane przeciwko peroksydazie tarczycowej, zawarte w komórkach tarczycy i odpowiedzialne za tworzenie aktywnej formy jodu do syntezy hormonów tarczycy. Pojawienie się przeciwciał przeciwko temu enzymowi we krwi zaburza jego normalne funkcjonowanie, co skutkuje zmniejszeniem produkcji odpowiednich hormonów. Są specyficznym wyznacznikiem choroby autoimmunologiczne Tarczyca.
Przeciwciała przeciwko peroksydazie tarczycowej- specyficzne immunoglobuliny skierowane przeciwko peroksydazie tarczycowej, zawarte w komórkach tarczycy i odpowiedzialne za tworzenie aktywnej formy jodu do syntezy hormonów tarczycy. Pojawienie się przeciwciał przeciwko temu enzymowi we krwi zaburza jego normalne funkcjonowanie, co skutkuje zmniejszeniem produkcji odpowiednich hormonów. Są specyficznym wyznacznikiem choroby autoimmunologiczne Tarczyca.
Wartości referencyjne są mniejsze niż 5,6 U/ml.
Przyczyny zwiększonego poziomu przeciwciał przeciwko peroksydazie tarczycowej w surowicy krwi:
- przewlekłe autoimmunologiczne zapalenie tarczycy;
- zanikowe zapalenie tarczycy;
- wole guzkowe toksyczne;
- rozlane wole toksyczne;
- idiopatyczna niedoczynność tarczycy.
Prekursorem hormonów tarczycy T4 i T8 jest tyreoglobulina. To jest to wartość laboratoryjna jest markerem nowotworów tarczycy, a u pacjentów po usunięciu tarczycy lub podczas terapii jodem radioaktywnym – w celu oceny skuteczności leczenia.
Wartości referencyjne są mniejsze niż 55 ng/ml.
Analiza hormonalna tyreoglobuliny
 Tyreoglobulina jest prekursorem trójjodotyroniny (T3) i tyroksyny (T4). Jest wytwarzany wyłącznie przez komórki tarczycy i gromadzi się w jej pęcherzykach w postaci koloidu. Podczas wydzielania hormonów do krwi dostają się niewielkie ilości tyreoglobuliny. Z nieznanych przyczyn może stać się autoantygenem, w odpowiedzi organizm wytwarza przeciwko niemu przeciwciała, co powoduje zapalenie tarczycy.
Tyreoglobulina jest prekursorem trójjodotyroniny (T3) i tyroksyny (T4). Jest wytwarzany wyłącznie przez komórki tarczycy i gromadzi się w jej pęcherzykach w postaci koloidu. Podczas wydzielania hormonów do krwi dostają się niewielkie ilości tyreoglobuliny. Z nieznanych przyczyn może stać się autoantygenem, w odpowiedzi organizm wytwarza przeciwko niemu przeciwciała, co powoduje zapalenie tarczycy.
ATTG może blokować tyreoglobulinę, zaburzając prawidłową syntezę hormonów tarczycy i powodując niedoczynność tarczycy, lub odwrotnie, nadmiernie pobudzać gruczoł, powodując jego nadczynność.
Przeciwciała antytyreoglobulinowe to specyficzne immunoglobuliny skierowane przeciwko prekursorowi hormonów tarczycy. Są swoistym markerem autoimmunologicznych chorób tarczycy (choroba Gravesa-Basedowa, zapalenie tarczycy Hashimoto).
Wartości referencyjne są mniejsze niż 18 U/ml.
Przyczyny zwiększenia poziomu przeciwciał przeciwko tyreoglobulinie w surowicy krwi:
- przewlekłe zapalenie tarczycy;
- idiopatyczna niedoczynność tarczycy;
- autoimmunologiczne zapalenie tarczycy;
- rozlane wole toksyczne.
Badanie hormonalne tarczycy na kalcytoninę
Tak zwane komórki C tarczycy wytwarzają inny hormon – kalcytoninę, której główną funkcją jest regulacja metabolizmu wapnia. W medycynie klinicznej badanie surowicy krwi na obecność tego hormonu tarczycy jest ważne w diagnostyce szeregu chorób tarczycy i niektórych innych narządów.
Tabela „Normy badania hormonu tarczycy – kalcytoniny”:
Przyczyny wzrostu poziomu kalcytoniny w surowicy krwi rozwijają się:
- rak rdzeniasty tarczycy (przy tej patologii znacznie wzrasta, oznaczenie hormonu jest markerem powyższej choroby, a także kryterium wyleczenia po usunięciu tarczycy i braku przerzutów);
- nadczynność przytarczyc;
- Niedokrwistość złośliwa;
- Choroba Pageta;
- nowotwory płuc;
- niektóre rodzaje nowotworów złośliwych piersi, żołądka, nerek i wątroby.
Należy pamiętać, że standardy referencyjne dla badań krwi na obecność hormonów tarczycy mogą różnić się w zależności od laboratorium, w zależności od zastosowanej metody badania.
Poniżej opisujemy jakie badania należy wykonać na obecność hormonów nadnerczy.
Jakie badania wykonać na hormony nadnerczy
Nadnercza- Są to obwodowe gruczoły dokrewne, umiejscowione anatomicznie na szczytach obu nerek. Histologicznie wyróżnia się strefy wytwarzające hormony o różnych kierunkach działania:
- warstwa korowa (lokalizacja powstawania hormonów kortykosteroidowych i androgenów);
- rdzeń (lokalizacja powstawania hormonów stresu - adrenaliny i noradrenaliny).
Kortyzol - hormon steroidowy wydzielany przez korę nadnerczy. Główną funkcją kortyzolu jest regulacja gospodarki węglowodanowej (stymulacja glukoneogenezy), udział w kształtowaniu reakcji organizmu na stres.
Aby zbadać poziom hormonów nadnerczy, należy pamiętać, że poziom kortyzolu we krwi ulega codziennym wahaniom. Maksymalne stężenie obserwowane rano, minimalne - wieczorem. W czasie ciąży może nastąpić wzrost poziomu kortyzolu i zakłócenie dobowego rytmu jego uwalniania.
Tabela „Normalna analiza hormonalna zawartości kortyzolu w surowicy krwi”:
Aldosteron jest hormonem mineralokortykoidowym wytwarzanym w komórkach kory nadnerczy z cholesterolu. Główną funkcją hormonu jest regulacja metabolizmu sodu i potasu oraz dystrybucji elektrolitów - zatrzymywanie sodu w organizmie poprzez jego ponowne wchłanianie w kanalikach nerkowych, wydalanie jonów potasu i wodoru z moczem, wpływ na wydalanie sodu w kale.
Standardowa zawartość aldosteronu w surowicy krwi:
- bezpośrednio po przebudzeniu (w pozycji leżącej) – 15-150 pg/ml;
- w dowolnej innej pozycji - 35-350 pg/ml.
Tabela " Przyczyny patologiczne zmiany stężenia aldosteronu w surowicy”:
Adrenalina jest hormonem rdzenia nadnerczy. Jego główną rolą jest udział w odpowiedzi organizmu na stres: zwiększa częstość akcji serca, podnosi ciśnienie krwi, rozszerza naczynia krwionośne mięśni i serca oraz zwęża naczynia krwionośne skóry, błon śluzowych i narządów Jama brzuszna, aktywuje procesy rozkładu tłuszczów i glikogenu, zwiększając poziom glukozy we krwi.
Noradrenalina jest wytwarzana w małych ilościach w rdzeń nadnercza, a większość z nich pochodzi z zakończeń nerwów współczulnych. Hormon ten różni się od adrenaliny silniejszym działaniem zwężającym naczynia krwionośne, słabszym działaniem stymulującym serce, słabym działaniem rozszerzającym oskrzela i brakiem wyraźnego efektu hiperglikemicznego.
Tabela „Normatywna zawartość adrenaliny w analizie surowicy krwi na obecność hormonów nadnerczy”:
Tabela: „Normy dotyczące badań stężenia hormonu nadnerczy – noradrenaliny w surowicy krwi”:
W praktyce klinicznej najczęściej zleca się badanie krwi na obecność hormonów nadnerczy, adrenaliny i noradrenaliny, w celu rozpoznania guza chromochłonnego, nowotworu wytwarzającego te hormony, np. diagnostyka różnicowa nadciśnienie tętnicze oraz monitorowanie skuteczności leczenia chirurgicznego guzów chromochłonnych.
Tabela „Patologiczne przyczyny zmian stężenia adrenaliny i noradrenaliny w surowicy krwi”:
Ostatnia część artykułu poświęcona jest zalecanym badaniom na hormony płciowe.
Jakie badania wykonać na hormony płciowe
Hormony płciowe dzieli się na grupy ze względu na ich działanie biologiczne:
- estrogeny (estradiol itp.);
- gestageny (progesteron);
- androgeny (testosteron).
W organizmie kobiety miejscem syntezy głównych hormonów płciowych są jajniki i kora nadnerczy, a w czasie ciąży także łożysko. U mężczyzn zdecydowana większość hormonów płciowych (androgenów) jest syntetyzowana w jądrach, a tylko niewielka ich ilość jest syntetyzowana w korze nadnerczy. Podstawą biochemiczną sterydów płciowych jest cholesterol.
Estradiol- To jest główny estrogen. U kobiet jest syntetyzowana w jajnikach, komórkach błonowych i ziarnistych pęcherzyków, a jego poziom waha się w zależności od fazy cyklu miesiączkowego. Główną funkcją hormonu jest rozwój wtórnych cech płciowych, determinuje charakterystyczne cechy fizyczne i cechy psychiczne kobiece ciało.
W czasie ciąży dodawany jest inny narząd wytwarzający estradiol – łożysko. Oznaczenie poziomu estradiolu u kobiet w wieku rozrodczym jest niezbędne przede wszystkim w celu oceny czynności jajników.
Tabela „Normatywna zawartość estradiolu w surowicy krwi mężczyzn przy analizie hormonów płciowych”:
Tabela „Patologiczne przyczyny zmian stężenia estradiolu w surowicy krwi”:
Progesteron- wytwarzany żeński hormon steroidowy żółte ciało jajnik, sprzyja proliferacji błony śluzowej macicy, co zapewnia implantację zarodka po zapłodnieniu, hormon ten nazywany jest „hormonem ciąży”. Zaleca się badanie krwi na obecność progesteronu, hormonu płciowego, w celu potwierdzenia obecności lub braku owulacji podczas cyklu miesiączkowego u kobiet, w czasie ciąży.
Tabela „Normatywne wyniki badań hormonu progesteronu u kobiet w surowicy krwi”:
Tabela „Standardy badania hormonu progesteronu u chłopców w zależności od etapu dojrzewania według Tannera”:
Tabela „Wyniki referencyjne analizy hormonalnej progesteronu u dziewcząt w zależności od etapu dojrzewania według Tannera”:
Tabela „Patologiczne przyczyny zmian stężenia progesteronu w surowicy krwi”:
Testosteron- hormon androgenny odpowiedzialny za drugorzędowe cechy płciowe u mężczyzn, stymulację spermatogenezy, utrzymanie libido i potencji, hormon ma również działanie anaboliczne. Miejscem syntezy są komórki Leydiga jąder.
Tabela „Normy zawartości hormonu testosteronu w badaniu surowicy krwi u mężczyzn”:
Tabela „Normy poziomu testosteronu w analiza hormonalna surowica krwi u kobiet”:
Tabela „Patologiczne przyczyny zmian stężenia testosteronu w surowicy krwi”:
Ten artykuł przeczytano 5157 razy.
Nasze hormony odgrywają tu kluczową rolę ważna rola w organizowaniu systematycznego i efektywnego funkcjonowania całego organizmu, zatem jeśli mamy do czynienia z zaburzeniem równowagi hormonalnej, ma to ogromny wpływ na nasze zdrowie.
Oczywiście jest wiele hormonów, które spełniają w nas swoje funkcje, ale są takie, które najczęściej powodują problemy, wytrącając nasze zdrowie z równowagi – hormony stresu, hormony tarczycy, hormony płciowe i insulina, która kontroluje poziom cukru we krwi.
Najczęstszą przyczyną braku równowagi zdrowotnej jest brak równowagi hormonalnej. Oznacza to, że równoważenie hormonów powinno znajdować się na szczycie wszystkich list rzeczy do zrobienia dla naszego zdrowia.
Ale skąd wiesz, że cierpisz na taki brak równowagi?

Jeśli cierpisz na jeden lub więcej z tych objawów braku równowagi, Twoje hormony mogą być niezrównoważone:
- Przyrost masy ciała i/lub tłuszcz na brzuchu
- Depresja, lęk i drażliwość
- Wahania nastroju
- Strata libido
- Problemy trawienne
- Zmęczenie
- Problemy ze snem
- Problemy z prokreacją
- Nadmierne pocenie
Dość długa lista, prawda?
Ale dobra wiadomość jest taka, że istnieją sposoby na zrównoważenie hormonów, dzięki czemu możesz znów czuć się dobrze. Zmieniając dietę i styl życia, z czasem Twoje poziom hormonów będą w stanie się regulować.

Oczywiście, że syntetyczne metody hormonalne zabiegi i inne opcje, po które sięga wiele osób – działają znacznie szybciej niż dieta. Ale bez względu na to, jak kuszące może to być, zdobyć szybka decyzja badania pokazują, że mogą wystąpić skutki uboczne stosowania syntetycznej terapii hormonalnej więcej problemów niż dobry.
Może to prowadzić do zwiększonego ryzyka wystąpienia chorób takich jak:
- Rak sutka
- Udar
- Zawał serca
- Osteoporoza
- Wysokie ciśnienie krwi
- Krwawienie z pochwy
- Wysypki skórne i trądzik
- Przybranie na wadze
Dlatego zmiana diety i stylu życia może być dłuższą podróżą, ale jednocześnie bardziej stabilną i obiecującą.
Jednakże, w zależności od osobistego stanu zdrowia, należy zawsze postępować zgodnie z zaleceniami lekarza dotyczącymi leków i leczenia.
Jak zrównoważyć hormony dietą
Jeśli zdecydujesz się jechać naturalnie, to prawdopodobnie zastanawiasz się, co powinieneś, a czego nie powinieneś robić, aby zrównoważyć swoje hormony.
Rozłóżmy to na części i zobaczmy, co powinieneś zrobić.

Jednym z kluczowych sposobów prawidłowego działania naszych hormonów jest dostarczanie organizmowi krótko-, średnio- i długołańcuchowych kwasów tłuszczowych.
Nie tylko nasz organizm efektywnie wykorzystuje te tłuszcze produkcja hormonów(zwłaszcza hormony płciowe), ale metabolizm całego organizmu stanie się o krok wyższy.
Dobre tłuszcze pomogą nam również uniknąć uczucia głodu na dłużej i dodadzą smaku naszym posiłkom.
Pamiętaj, aby każdego dnia spożywać olej lniany, oliwki, żółtka jaj, awokado i łososia oraz inne produkty.
Zrównoważ swoje kwasy Omega 3 i Omega 6

Mówiłem już wcześniej o znaczeniu zrównoważenia proporcji spożywanych przez nas kwasów tłuszczowych omega-3 i omega-6.
Ponieważ przetworzona żywność i oleje roślinne zawierają ogromne ilości kwasów omega-6, musimy ograniczyć spożycie i zwiększyć spożycie żywności bogatej w kwasy tłuszczowe omega-3, aby przywrócić równowagę... ale większość z nas tego nie robi.
Konsekwencją naszych zaniedbań jest wzrost liczby przewlekłych chorób zapalnych na tle zaburzeń hormonalnych.
Unikać oleje roślinne bogate w kwasy tłuszczowe omega-6, takie jak oleje słonecznikowy, sojowy, arachidowy, z nasion bawełny i inne. Przetworzona żywność może również zawierać zbyt dużo tych olejów.
Ciesz się większą ilością tłustych ryb, nasion lnu, nasion chia i orzechów, które są bogate w zwalczające stany zapalne kwasy tłuszczowe omega-3.
Wypróbuj żywność probiotyczną

Te pokarmy zawierają wiele pożytecznych bakterii i drożdży (znanych jako probiotyki), które promują zdrowie układ trawienny, a nasze zdrowe jelita mają ogromny wpływ na nasz ogólny stan zdrowia.
Pożyteczne bakterie i drożdże w naszych jelitach pomagają wchłaniać i przetwarzać hormony (estrogeny, takie jak fitoestrogeny i hormony tarczycy) ze źródeł pożywienia, co pomaga w utrzymaniu właściwej równowagi hormonalnej.
Kombucha, kefir, kiszona kapusta i domowy jogurt są źródłami mikrobiologicznego gojenia jelit. Powinieneś starać się jeść te produkty codziennie.

Poważnie, istnieją pokarmy, które mogą pomóc Ci zasnąć w nocy.
Zapewnienie odpowiedniej ilości snu (mówię o siedmiu do ośmiu godzinach dziennie) jest absolutnie niezbędne do zrównoważenia hormonów.
Jak wszystko – hormony działają według harmonogramu. Weźmy na przykład kortyzol. Jest to hormon stresu, którego poziom reguluje się podczas snu. Jeśli nie będziemy się wysypiać, możemy spodziewać się wielu stresujących problemów, taki takie jak przyrost masy ciała, problemy z sercem, problemy z trawieniem, brak równowagi poziomu cukru we krwi i inne.
Brak snu jest faktem obniża poziom leptyny(hormon tłumiący apetyt) i zwiększa poziom greliny (hormonu stymulującego głód). Nic dziwnego, że osoby pozbawione snu częściej odczuwają głód i mają ochotę na węglowodany, słodycze i słone potrawy. Wiem, że kiedy nie śpię wystarczająco dużo, zdecydowanie chcę jeść więcej.
Aby więc pozostać wypoczętym i zrównoważonym, musisz jeść warzywa, produkty pełnoziarniste, migdały i inne produkty powodujące sen.

Rodzaj wybranych węglowodanów może mieć duży wpływ na dwa hormony w organizmie: insulinę i leptynę.
Jedzenie prostych węglowodanów, takich jak biały chleb, makarony, ciasta i wypieki z przetworzonej białej mąki, prowadzi do szybkiego wzrostu Na poziom cukru we krwi i insuliny, co może mieć negatywne konsekwencje zdrowotne. W dłuższej perspektywie może to prowadzić do insulinooporności, wpływać na zdolność spalania tłuszczu, a nawet prowadzić do cukrzycy.
Jeśli wybierzesz węglowodany złożone, takie jak produkty pełnoziarniste, warzywa, będzie to znacznie lepsze dla Twojego zdrowia i hormonów.
Te pokarmy pomagają również ustabilizować poziom leptyny, która następnie sygnalizuje organizmowi, aby zmniejszył głód, zwiększył tempo spalania i ograniczył odkładanie się tłuszczu, szczególnie w okolicach talii.
Węglowodany złożone są zwykle bogate w błonnik, podczas gdy węglowodany proste nie, ale błonnik pomaga wydać nadmiar estrogenów z organizmu, co również prowadzi do równowagi.

Korzeń Maca, pochodzący z gór Peru, szybko zyskuje reputację świetnego sposobu na naturalną równowagę hormonów. Jest znany jako adaptogen hormonalny, co oznacza, że nie zawiera żadnych hormonów, ale je zawiera składniki odżywcze, niezbędne do wspierania produkcji hormonów.
Badania zarówno na mężczyznach, jak i na kobietach wykazały, że maca bezpiecznie i skutecznie równoważy poziom hormonów, zmniejsza skutki uboczne zaburzeń równowagi hormonalnej i zwiększa płodność.
Korzeń Maca jest dostępny w postaci proszku i kapsułek, które można dodać do koktajlu lub nawet z nim wymieszać zwykła woda. Uwaga – proszek smakuje gorszy od kapsułek, ale zwykle kosztuje znacznie mniej niż kapsułki.

Lekarze wciąż próbują dowiedzieć się, jak witamina D działa w organizmie i jaki jest jej wpływ na nasz organizm ogólne zdrowie. Ale jednego, czego wszyscy są pewni, jest to, że jest to bardzo ważna witamina. Zatem uzyskanie odpowiedniego poziomu witaminy D jest bardzo istotne ważny czynnik w utrzymaniu równowagi hormonalnej w całym organizmie, a także zdrowego układu odpornościowego.
Magnez odgrywa ważną rolę w regulacji poziomu hormonów płciowych, w tym testosteronu i hormonu wzrostu, hormonu stymulującego wzrost, reprodukcję komórek i regenerację komórek. Ten ważny minerał, w którym więcej dwie trzecie ludzi jest mało. Może również pomóc Ci się zrelaksować i lepiej spać, równoważąc poziom hormonów w nocy podczas snu.
Możesz uzyskać witaminę D ze słońca lub suplementów, a jeśli jesz dużo warzyw liściastych, orzechów i nasion, awokado, soi, aby uzyskać magnez.

Mam wrażenie, że wielu tego nie poprze, bo tak miło jest napić się orzeźwiającej kawy o poranku. Niestety, jeśli poziom hormonów nie jest zsynchronizowany, picie zbyt dużej ilości kofeiny jest bardzo szkodliwe.
Kofeina może wpływać na hormon wzrostu HGH, który pomaga utrzymać masę mięśniową i kostną w wieku dorosłym. Może również podnosić poziom kortyzolu – hormonu tarczycy, który zakłóca nasz spokojny sen.
Zamień kawę na filiżankę zielonej herbaty. Nadal będziesz otrzymywać trochę kofeiny, ale z wieloma innymi korzyściami zdrowotnymi.
A teraz więcej złych wiadomości. Jeśli pozwalasz sobie na lampkę wina lub piwa przed snem, najlepiej ograniczyć je do minimum, gdy starasz się osiągnąć równowagę hormonalną. Alkohol może zakłócać przetwarzanie estrogenów w organizmie. Zakłóca także sen, a jak już wiemy, brak snu wpływa na gospodarkę hormonalną.

Tak jak proste węglowodany wpływają na poziom insuliny i leptyny, tak samo wpływa cukier, ponieważ cukier jest prostym węglowodanem. Czy zauważyłeś kiedyś, że po zjedzeniu słodyczy stajesz się szczęśliwy, ale po kilku minutach lub godzinach stajesz się zrzędliwy, drażliwy i niespokojny? Cukier ten wpływa na równowagę hormonów estrogenu i progesteronu.
Oczywiście nie można całkowicie wyeliminować cukru – oznaczałoby to wycięcie owoców, warzyw, fasoli. Celem jest całkowite unikanie dodatku cukru i wybieranie pełnowartościowej żywności o niskim indeksie glikemicznym.

Gotowe posiłki, pakowane zupy, sosy i fast foody zawierają obrzydliwa ilość tłuszcze trans, niezdrowe oleje roślinne, cukry i wątpliwe dodatki, takie jak słodziki, MSG i azotany.
Sztuczne słodziki, takie jak aspartam – powszechny składnik przetworzonej żywności – również powiązano z niepłodnością, wadami wrodzonymi i zaburzeniami endokrynologicznymi prowadzącymi do braku równowagi hormonalnej.
Co jeszcze mogę zrobić?
Omówiliśmy więc podstawowe zmiany w diecie, które możesz wprowadzić, aby zrównoważyć hormony, ale są i dalej coś, co możesz zrobić, aby wspomóc ten proces. Jak zawsze, dieta może odgrywać rolę w zdrowiu główna rola, ale inne zmiany w stylu życia mogą być bardzo pomocne.

To, czego używasz do przechowywania i przygotowywania żywności, może również mieć wpływ na Twoje zdrowie i hormony. Plastikowe i nieprzywierające powłoki mogą powodować szkodliwe skutki chemikalia wejść do pożywienia i ciała. Istnieje wiele dowodów na to, że przybory kuchenne mogą zakłócać pracę hormonów rozrodczych i powodować wczesne dojrzewanie oraz nieregularną owulację.
Naprawdę nie mogę zrozumieć, dlaczego tego rodzaju materiały wciąż mogą być wokół nas, ale to fakt.
Ćwiczenia są ważne (ale nie przesadzaj)

Każdy powinien angażować się w regularne ćwiczenia, ale jeśli masz brak równowagi hormonalnej, intensywne i wyczerpujące ćwiczenia mogą nie być najlepszym sposobem na wsparcie organizmu.
Dopóki nie powrócisz do równowagi hormonalnej, skup się na aktywnościach stymulujących, takich jak chodzenie i pływanie. Możesz także spróbować krótkiej 20-minutowej sesji trening interwałowy trzy razy w tygodniu, aby pomóc przywrócić prawidłowe hormony.
Delikatne ćwiczenia pomogą Ci lepiej spać, poprawią nastrój i pomogą kontrolować przyrost masy ciała – wszystkie objawy braku równowagi hormonalnej.

Codziennie pij dużo wody lub wody z cytryną, aby utrzymać nawodnienie organizmu na tyle, aby móc pracować jeszcze efektywniej. Hormony, które są wszędzie, mogą mieć daleko idący wpływ na zdrowie fizyczne i psychiczne.
Zdrowe odżywianie, ćwiczenia i redukcja stresu zdziałają cuda, Twoje hormony zrównoważą się, dzięki czemu będziesz wyglądać i czuć się wspaniale.
Czy kiedykolwiek udało Ci się skutecznie regulować hormony za pomocą diety lub innych metod? Jak zawsze czekam na Wasze komentarze.
|
wstęp Oddzielne jedzenie I.1 Oddzielne żywienie ma swoją historię I.2 Nie można mówić o całkowitym porzuceniu czegokolwiek I.4 Jedz osobno, bo tak jest mądrze I.6 Kluczem jest równowaga I.9 Nasze niezbędne produkty roślinne I.14 Problemy tych, którzy jadają poza domem I.14 Dobowe rytmy wchłaniania pokarmu jedzenie i choroby II.1 Odżywienie, masa ciała i stan hormonalny organizmu II.3 Migrena i odżywianie II.4 Choroby pokarmowe i zakaźne II.5 Tłuszcze, stres i odżywianie II.6 Słodka żywność – gorzka kara Wniosek Bibliografia Aplikacje Załącznik nr 1. Średnie dzienne, zrównoważone zapotrzebowanie osoby dorosłej na składniki odżywcze i energię (wzór zrównoważone odżywianie A. A. Pokrovsky) |
WSTĘP
Rosja ma kulturę niskiej wiedzy żywieniowej. Opierają się na tradycyjnych podejściach, nie uwzględniają zmian w składzie spożywanych produktów, są niespójne i często zaprzeczają wiedzy z zakresu fizjologii człowieka.
A co się dzieje z naszą tradycyjną dietą? Owsianka z masłem (skrobia z tłuszczami) lub owsianka z mlekiem (skrobia z białkami) po wejściu do żołądka zamienia się w mieszaninę kwaśnych i środowisko alkaliczne, które neutralizują się nawzajem. W neutralnym środowisku składniki odżywcze nie ulegają rozkładowi, ale są przetwarzane przez gnilne bakterie żyjące w żołądku. W rezultacie powstaje tam gnijące „wysypisko śmieci”. Aby się go pozbyć, organizm zmuszony jest zmobilizować swoje siły obronne, wyprodukować dużą liczbę leukocytów, co wymaga dodatkowej energii, więc jeśli po tradycyjnym śniadaniu od razu chce się zjeść, oznacza to, że organizm (jego komórki) pozostał głodny i wydał swoją energię na neutralizację „śmieci” (leukocytoza pokarmowa).
Tradycyjny obiad - zupa bulion mięsny– tłuszcze + skrobie + białka. Po raz kolejny mamy do czynienia z sytuacją pełności w żołądku, która jest mylona z sytością.
Organizm ludzki ma bardzo duży margines bezpieczeństwa. Obliczenia naukowe pokazują, że żywotność może wynosić 400 lat. Młodzi ludzie jedzą wszystko i mówią, że wszystko jest w porządku. Ale po 30-35 latach człowiek zaczyna nabywać „bukiet chorób”. Rano nie ma wigoru, po południu senność, wieczorem zmęczenie - staje się to normalnym stanem dojrzałej osoby. Nie powinno tak być. Narodziny chorych dzieci (prawie nie rodzi się zdrowych) wskazują, że margines bezpieczeństwa ludzkości został wyczerpany. Rozpoczęła się selekcja naturalna. Ilość zdrowia zmniejsza się z każdym pokoleniem. Jeżeli zdrowie naszych dziadków przyjmiemy jako 100%, to dla ojców jest to 50%, dla naszego pokolenia – dzieci – 25%, kolejne pokolenie jest całe chore od chwili poczęcia. Przetrwanie zapewniają jedynie leki, środki zapobiegawcze, prawidłowe odżywianie i utrzymanie zdrowego trybu życia.
Oddzielne jedzenie
