Постійна больцмана формула. Постійна Больцмана: значення та фізичний сенс
Постійна Больцмана (kабо k b) - фізична постійна, що визначає зв'язок між і . Названа на честь австрійського фізика , який зробив великий внесок у , в якій ця постійна грає ключову роль. Її експериментальне значення в системі одно
k = 1,380 \; 6505 (24) \ times 10 ^ (-23) / .Числа у круглих дужках вказують стандартну похибку в останніх цифрах значення величини. У принципі, постійна Больцмана може бути отримана з визначення абсолютної температури та інших постійних фізичних. Однак, обчислення постійної Больцмана за допомогою основних принципів надто складне та нездійсненне за сучасного рівня знань. У природній системі одиниць Планка природна одиниця температури визначається так, що постійна Больцмана дорівнює одиниці.
Зв'язок між температурою та енергією.
Визначення ентропії.
Термодинамічна система визначається як натуральний логарифм від числа різних мікростанів Z, відповідних даному макроскопічному стану (наприклад, стану із заданою повною енергією).
S = k \, \ln ZКоефіцієнт пропорційності kі є стала Больцмана. Цей вираз, що визначає зв'язок між мікроскопічними (Z) та макроскопічними станами (S), виражає центральну ідею статистичної механіки.
Постійна Больцмана (k (\displaystyle k)або k B (\displaystyle k_(\rm (B)))) - фізична постійна, що визначає зв'язок між температурою та енергією. Названа на честь австрійського фізика Людвіга Больцмана, який зробив великий внесок у статистичну фізику, в якій ця стала грає ключову роль. Її значення у Міжнародній системі одиниць СІ відповідно до зміни визначень основних одиниць СІ (2018) точно дорівнює
k = 1,380 649 × 10 − 23 (\displaystyle k=1(,)380\,649\times 10^(-23))Дж/.Зв'язок між температурою та енергією
В однорідному ідеальному газі, що знаходиться за абсолютної температури T (\displaystyle T), енергія, що припадає на кожну поступальну ступінь свободи, дорівнює, як випливає з розподілу Максвелла, k T/2 (\displaystyle kT/2). При кімнатній температурі (300 ) ця енергія становить 2 , 07 × 10 − 21 (\displaystyle 2(,)07\times 10^(-21))Дж, або 0,013 еВ. В одноатомному ідеальному газі кожен атом має три ступені свободи, що відповідають трьом просторовим осям, що означає, що на кожен атом припадає енергія в 3 2 k T (\displaystyle (\frac (3)(2))kT).
Знаючи теплову енергію, можна обчислити середньоквадратичну швидкість атомів, яка обернено пропорційна квадратному кореню атомної маси. Середньоквадратична швидкість за кімнатної температури змінюється від 1370 м/с для гелію до 240 м/с для ксенону. У разі молекулярного газу ситуація ускладнюється, наприклад, двоатомний газ має 5 ступенів свободи - 3 поступальні та 2 обертальні (при низьких температурах, коли не порушені коливання атомів у молекулі і не додаються додаткові ступені свободи).
Визначення ентропії
Ентропія термодинамічної системи визначається як натуральний логарифм від різних мікростанів Z (\displaystyle Z), що відповідають даному макроскопічному стану (наприклад, стану із заданою повною енергією).
S = k ln Z. (\displaystyle S=k\ln Z.)Коефіцієнт пропорційності k (\displaystyle k)і є стала Больцмана. Це вираз, що визначає зв'язок між мікроскопічними ( Z (\displaystyle Z)) та макроскопічними станами ( S (\displaystyle S)), висловлює центральну ідею статистичної механіки.
Згідно із законом Стефана – Больцмана, щільність інтегрального напівсферичного випромінювання. E 0залежить тільки від температури та змінюється пропорційно четвертого ступеня абсолютної температури T:
Стефана – Больцмана постійна σ 0 – фізична постійна, яка входить до закону, що визначає об'ємну щільність рівноважного теплового випромінювання абсолютно чорного тіла:
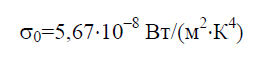
Історично закон Стефана-Больцмана був сформульований раніше за закон випромінювання Планка, з якого він випливає як наслідок. Закон Планка встановлює залежність спектральної густини потоку випромінювання E 0 від довжини хвилі λ та температури T:

де λ - Довжина хвилі, м; з=2,998 10 8 м/с – швидкість світла у вакуумі; Т- Температура тіла, К;
h= 6,625×10 -34 Дж×с– постійна Планка.
Фізична постійна k, рівна відношенню універсальної газової постійної R=8314Дж/(кг× K) до Авогадро NA=6,022× 10 26 1/(кг× моль):

Число різних конфігурацій системи з Nчастинок для цього набору чисел n i(кількість частинок, що знаходяться в i-тому стані, якому відповідає енергія e i) пропорційно величині:

Величина Wє кількість способів розподілу Nчастинок за енергетичними рівнями. Якщо справедливе співвідношення (6) вважається, що вихідна система підпорядковується статистиці Больцмана. Набір чисел n i, при якому число Wмаксимально, зустрічається найчастіше і найбільш ймовірному розподілу.
Фізична кінетика– мікроскопічна теорія процесів у статистично нерівноважних системах.
Опис великої кількості часток може успішно здійснюватися імовірнісними методами. Для одноатомного газу стан сукупності молекул визначається їх координатами та значеннями проекцій швидкостей відповідні координатні осі. Математично це описується функцією розподілу, що характеризує можливість перебування частки в даному стані:

є очікуване число молекул в обсязі d d , координати яких знаходяться в інтервалі від + d , а швидкості в інтервалі від + d.
Якщо середньою за часом потенційною енергією взаємодії молекул можна знехтувати порівняно з їхньою кінетичною енергією, то газ називається ідеальним. Ідеальний газ називається газом Больцмана, якщо відношення довжини пробігу молекул у цьому газі до характерного розміру течії Lзвісно, тобто.

т.к. довжина пробігу обернено пропорційна nd 2(n – числова щільність 1/м 3 , d – діаметр молекули, м).
Величину

називають H-функцією Больцмана для одиниці об'єму, яка пов'язана з ймовірністю виявлення системи молекул газу в даному стані. Кожному стану відповідають певні числа заповнення шестивимірних просторово-швидкісних осередків, на які може бути розбитий фазовий простір молекул, що розглядаються. Позначимо Wймовірність того, що в першому осередку розглянутого простору виявиться N 1 молекул, у другому N 2 і т.д.
З точністю до постійної, що визначає початок відліку ймовірності, правомірне співвідношення:
 ,
,
де  – H-функція області простору А, зайнятий газом. З (9) видно, що Wі Hвзаємопов'язані, тобто. зміна ймовірності стану призводить до відповідної еволюції функції H.
– H-функція області простору А, зайнятий газом. З (9) видно, що Wі Hвзаємопов'язані, тобто. зміна ймовірності стану призводить до відповідної еволюції функції H.

Больцмана принцип встановлює зв'язок між ентропією Sфізичної системи та термодинамічної ймовірністю Wїї стану:

(друкується за виданням: Коган М.Н. Динаміка розрідженого газу. - М.: Наука, 1967)
Загальний вигляд КУБ:

де - масова сила, обумовлена наявністю різних полів (гравітаційного, електричного, магнітного), що діє на молекулу; J- Інтеграл зіткнень. Саме цей член рівняння Больцмана враховує зіткнення молекул одна з одною та відповідні зміни швидкостей взаємодіючих частинок. Інтеграл зіткнень є п'ятивимірним інтегралом і має наступну структуру:

Рівняння (12) з інтегралом (13) отримано зіткнення молекул, у яких немає тангенціальних сил, тобто. частинки, що стикаються, вважаються ідеально гладкими.
У процесі взаємодії внутрішня енергія молекул змінюється, тобто. передбачається, що ці молекули є ідеально пружними. Розглядаються дві групи молекул, що мають до зіткнення один з одним (зіткнення) швидкості та (рис. 1), а після зіткнення відповідно швидкості і . Різниця швидкостей і називається відносною швидкістю, тобто. . Зрозуміло, що для гладкого пружного зіткнення. Функції розподілу f 1 ", f", f 1, fописують молекули відповідних груп після до зіткнень, тобто. ![]() ;
; ![]() ;
; ![]() ;
; ![]() .
.

Мал. 1. Зіткнення двох молекул.
(13) входять два параметри, що характеризують розташування зіштовхуються молекул один щодо одного: bта ε; b– прицільна відстань, тобто. найменша відстань, на яку зблизилися б молекули за відсутності взаємодії (рис. 2); ε називають кутовим параметром зіткнень (рис. 3). Інтегрування по bвід 0 до ¥ і по від 0 до 2p (два зовнішні інтеграли (12)) охоплює всю площину силової взаємодії перпендикулярно вектору

Мал. 2. Траєкторія руху молекул.

Мал. 3. Розгляд взаємодії молекул у циліндричній системі координат: z, b, ε
Кінетичне рівняння Больцмана виведено за таких припущень і припущень.
1. Вважається, що відбувається переважно зіткнення двох молекул, тобто. роль зіткнень одночасно трьох і більшої кількості молекул незначна. Це припущення дозволяє використовувати для аналізу одночасткову функцію розподілу, яка названа вище просто функцією розподілу. Врахування зіткнення трьох молекул призводить до необхідності використання в дослідженні двочастинної функції розподілу. Відповідно аналіз суттєво ускладнюється.
2. Припущення про молекулярний хаос. Воно виявляється у тому, що ймовірності виявлення частки 1 у фазовій точці та частинки 2 у фазовій точці незалежні один від одного.
3. Рівноймовірні зіткнення молекул з будь-якою прицільною відстанню, тобто. функція розподілу не змінюється діаметрі взаємодії. Необхідно відзначити, що аналізований елемент має бути малим, щоб fв межах цього елемента не змінювалася, але в той же час, щоб не була велика відносна флуктуація ~ . Потенціали взаємодії, використовувані під час обчислення інтеграла зіткнень, є сферично симетричними, тобто. ![]() .
.
Розподіл Максвелла-Больцмана
Рівноважний стан газу описується абсолютним Максвеллівським розподілом, який є точним рішенням кінетичного рівняння Больцмана:

де m - Маса молекули, кг.
Загальний локально-максвеллівський розподіл інакше званий розподіл Максвелла-Больцмана:

у тому випадку, коли газ рухається як ціле зі швидкістю і змінні n , T залежать від координати
та часу t.
У полі тяжіння Землі точне рішення рівняння Больцмана показує:
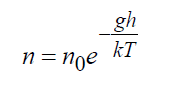
де n 0 = щільність біля Землі, 1/м 3 ; g- Прискорення сили тяжіння, м / с 2; h- Висота, м. Формула (16) є точним рішенням кінетичного рівняння Больцман або в безмежному просторі, або за наявності кордонів, що не порушують цього розподілу, при цьому температура також повинна залишатися постійною.
Ця сторінка оформлена Пузіною Ю.Ю. за підтримки Російського Фонду Фундаментальних досліджень – проект №08-08-00638.
Народився 1844 року у Відні. Больцман є першопрохідником і першовідкривачем у науці. Його роботи та дослідження часто були незрозумілі та відкинуті суспільством. Проте з подальшим розвитком фізики його праці було визнано та згодом опубліковано.
Наукові інтереси вченого охоплювали такі фундаментальні галузі, як фізика та математика. З 1867 року він працював викладачем у низці вищих навчальних закладів. У своїх дослідженнях він встановив, що обумовлено хаотичними ударами молекул об стінки судини, в якій вони знаходяться, тоді як температура безпосередньо залежить від швидкості руху частинок (молекул), інакше кажучи, від них. Отже, чим з більшою швидкістю рухаються ці частинки, тим вища і температура. Постійну Больцмана названо на честь знаменитого австрійського вченого. Саме він зробив неоціненний внесок у розвиток статичної фізики.
Фізичний зміст цієї постійної величини
Постійна Больцмана визначає зв'язок між такими як температура та енергія. У статичній механіці вона грає головну ключову роль. Постійна Больцмана дорівнює k = 1,3806505 (24) * 10 -23 Дж/К. Числа, що знаходяться у круглих дужках, вказують на допустиму похибку значення величини щодо останніх цифр. Постійна Больцмана також може бути отримана з інших фізичних постійних. Однак ці обчислення досить складні та важкоздійсненні. Вони вимагають глибоких знань у сфері фізики, а й
Метелики, звичайно, нічого не знають про зміїв. Зате про них знають птахи, що полюють на метеликів. Птахи, які погано розпізнають змій, частіше стають...
Октава називається інтервал між двома найближчими однойменними звуками: до і до, ре і ре і т. д. З точки зору фізики «спорідненість» цих...
У 27 році до зв. е. римський імператор Октавіан отримав титул Август, що латиною означає «священний» (на честь цього ж діяча, до речі,...
Відомий жарт говорить: «NASA витратило кілька мільйонів доларів, щоб розробити спеціальну ручку, здатну писати в космосі.
Відомо близько 10 мільйонів органічних (тобто заснованих на вуглеці) та лише близько 100 тисяч неорганічних молекул. В додаток...
На відміну від звичайного скла, кварцове пропускає ультрафіолет. У кварцових лампах джерелом ультрафіолету є газовий розряд у парах ртуті. Він...
При великому перепаді температур усередині хмари виникають потужні висхідні потоки. Завдяки їм краплі можуть довго триматися у повітрі та...
