Ang pare-parehong formula ni Boltzmann. Ang pare-pareho ni Boltzmann: kahulugan at pisikal na kahulugan
Boltzmann pare-pareho (k o k b) ay isang pisikal na pare-pareho na tumutukoy sa relasyon sa pagitan ng at . Pinangalanan pagkatapos ng Austrian physicist, na gumawa ng isang malaking kontribusyon sa, kung saan ang pare-parehong ito ay gumaganap ng isang mahalagang papel. Ang pang-eksperimentong halaga nito sa system ay
k = 1.380\;6505(24)\beses 10^(-23) / .Ang mga numero sa panaklong ay nagpapahiwatig ng karaniwang error sa mga huling digit ng halaga. Sa prinsipyo, ang pare-parehong Boltzmann ay maaaring makuha mula sa pagpapasiya ng ganap na temperatura at iba pang mga pisikal na pare-pareho. Gayunpaman, ang pagkalkula ng patuloy na Boltzmann gamit ang mga pangunahing prinsipyo ay masyadong kumplikado at imposible sa kasalukuyang antas ng kaalaman. Sa natural na sistema ng mga yunit ng Planck, ang natural na yunit ng temperatura ay ibinibigay sa paraang ang Boltzmann constant ay katumbas ng isa.
Relasyon sa pagitan ng temperatura at enerhiya.
Kahulugan ng entropy.
Ang thermodynamic system ay tinukoy bilang ang natural na logarithm ng bilang ng iba't ibang microstate Z na tumutugma sa isang ibinigay na macroscopic na estado (halimbawa, isang estado na may ibinigay na kabuuang enerhiya).
S = k \, \ln ZSalik ng proporsyonalidad k at ang Boltzmann constant. Ang expression na ito, na tumutukoy sa kaugnayan sa pagitan ng microscopic (Z) at macroscopic states (S), ay nagpapahayag ng pangunahing ideya ng statistical mechanics.
Ang pare-pareho ni Boltzmann (k (\displaystyle k) o k B (\displaystyle k_(\rm (B)))) ay isang pisikal na pare-pareho na tumutukoy sa kaugnayan sa pagitan ng temperatura at enerhiya. Pinangalanan pagkatapos ng Austrian physicist na si Ludwig Boltzmann, na gumawa ng malalaking kontribusyon sa statistical physics, kung saan ang pare-parehong ito ay gumaganap ng isang mahalagang papel. Ang halaga nito sa International System of Units SI ayon sa pagbabago sa mga kahulugan ng mga pangunahing yunit ng SI (2018) ay eksaktong katumbas ng
k = 1.380 649 × 10 − 23 (\displaystyle k=1(,)380\,649\beses 10^(-23)) J / .Relasyon sa pagitan ng temperatura at enerhiya
Sa isang homogenous na ideal na gas sa ganap na temperatura T (\displaystyle T), ang enerhiya sa bawat translasyon na antas ng kalayaan ay, tulad ng sumusunod mula sa pamamahagi ng Maxwell, kT / 2 (\displaystyle kT/2). Sa temperatura ng silid (300 ), ang enerhiya na ito ay 2 , 07 × 10 − 21 (\displaystyle 2(,)07\beses 10^(-21)) J, o 0.013 eV. Sa isang monatomic ideal na gas, ang bawat atom ay may tatlong antas ng kalayaan na tumutugma sa tatlong spatial axes, na nangangahulugan na ang bawat atom ay may enerhiya sa 3 2 k T (\displaystyle (\frac (3)(2))kT).
Ang pag-alam sa thermal energy, maaaring kalkulahin ng isa ang root-mean-square atomic velocity, na inversely proportional sa square root ng atomic mass. Ang root mean square velocity sa room temperature ay nag-iiba mula 1370 m/s para sa helium hanggang 240 m/s para sa xenon. Sa kaso ng isang molekular na gas, ang sitwasyon ay nagiging mas kumplikado, halimbawa, ang isang diatomic gas ay may 5 degrees ng kalayaan - 3 translational at 2 rotational (sa mababang temperatura, kapag ang mga vibrations ng mga atom sa isang molekula ay hindi nasasabik at karagdagang mga degree ng kalayaan ay hindi idinagdag).
Kahulugan ng entropy
Ang entropy ng isang thermodynamic system ay tinukoy bilang ang natural na logarithm ng bilang ng iba't ibang microstates Z (\displaystyle Z) naaayon sa isang ibinigay na macroscopic na estado (halimbawa, isang estado na may ibinigay na kabuuang enerhiya).
S = k log Z . (\displaystyle S=k\ln Z.)Salik ng proporsyonalidad k (\displaystyle k) at ang Boltzmann constant. Ito ay isang expression na tumutukoy sa kaugnayan sa pagitan ng mikroskopiko ( Z (\displaystyle Z)) at macroscopic na estado ( S (\displaystyle S)), ay nagpapahayag ng pangunahing ideya ng mga mekanika ng istatistika.
Ayon sa batas ng Stefan-Boltzmann, ang density ng integral hemispherical radiation E0 nakasalalay lamang sa temperatura at nag-iiba sa proporsyon sa ikaapat na kapangyarihan ng ganap na temperatura T:
Stefan - Boltzmann constant σ 0 ay isang pisikal na constant na kasama sa batas na tumutukoy sa volumetric density ng equilibrium thermal radiation ng isang itim na katawan:
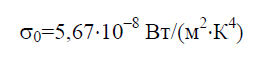
Sa kasaysayan, ang batas ng Stefan-Boltzmann ay nabuo bago ang batas ng radiation ni Planck, kung saan ito ay sumusunod bilang isang corollary. Itinatag ng batas ni Planck ang pagtitiwala sa spectral density ng radiation flux E 0 sa wavelength λ at temperatura T:

kung saan ang λ ay ang wavelength, m; Sa\u003d 2.998 10 8 m / s - ang bilis ng liwanag sa vacuum; T– temperatura ng katawan, K;
h\u003d 6.625 × 10 -34 J × s - Ang pare-pareho ng Planck.
Pisikal na pare-pareho k katumbas ng ratio ng universal gas constant R\u003d 8314J / (kg × K) sa numero ni Avogadro NA\u003d 6.022 × 10 26 1 / (kg × mol):

Bilang ng iba't ibang mga configuration ng system mula sa N mga particle para sa isang naibigay na hanay ng mga numero n i(bilang ng mga particle sa i-ang estado kung saan tumutugma ang enerhiya e i) ay proporsyonal sa halaga:

Halaga W mayroong ilang mga paraan upang ipamahagi N mga particle sa pamamagitan ng mga antas ng enerhiya. Kung ang kaugnayan (6) ay wasto, kung gayon ito ay itinuturing na ang orihinal na sistema ay sumusunod sa mga istatistika ng Boltzmann. Set ng mga numero n i, kung saan ang numero W maximum, nangyayari nang madalas, at tumutugma sa pinaka-malamang na pamamahagi.
Pisikal na kinetika– mikroskopiko na teorya ng mga proseso sa mga sistemang hindi balanseng istatistika.
Ang paglalarawan ng isang malaking bilang ng mga particle ay maaaring matagumpay na maisakatuparan ng mga probabilistikong pamamaraan. Para sa isang monatomic gas, ang estado ng isang hanay ng mga molekula ay tinutukoy ng kanilang mga coordinate at ng mga halaga ng mga projection ng bilis sa kaukulang coordinate axes. Sa matematika, ito ay inilalarawan ng isang distribution function na nagpapakilala sa posibilidad ng isang particle na nasa isang partikular na estado:

ay ang inaasahang bilang ng mga molekula sa volume d d , na ang mga coordinate ay nasa hanay mula hanggang +d , at ang mga bilis ay nasa hanay mula hanggang +d.
Kung ang oras-average na potensyal na enerhiya ng pakikipag-ugnayan ng mga molekula ay maaaring mapabayaan kung ihahambing sa kanilang kinetic energy, kung gayon ang gas ay tinatawag na perpekto. Ang isang perpektong gas ay tinatawag na isang Boltzmann gas kung ang ratio ng haba ng landas ng mga molekula sa gas na ito sa katangian ng laki ng daloy L siyempre, i.e.

kasi ang haba ng pagtakbo ay inversely proportional nd 2(n ay ang density ng numero 1/m3, d ay ang diameter ng molekula, m).
ang halaga

tinawag H- ang Boltzmann function para sa isang yunit ng volume, na nauugnay sa posibilidad ng pag-detect ng isang sistema ng mga molekula ng gas sa isang partikular na estado. Ang bawat estado ay tumutugma sa ilang partikular na bilang ng trabaho ng mga six-dimensional na space-velocity cell, kung saan maaaring hatiin ang phase space ng mga itinuturing na molekula. Magpakilala W ang posibilidad na sa unang cell ng espasyong isinasaalang-alang ay magkakaroon ng N 1 molecules, sa pangalawang cell N 2, atbp.
Hanggang sa isang pare-pareho na tumutukoy sa pinagmulan ng probabilidad, ang sumusunod na kaugnayan ay wasto:
 ,
,
saan  – H-function ng rehiyon ng espasyo PERO inookupahan ng gas. Mula sa (9) makikita na W at H magkakaugnay, i.e. ang isang pagbabago sa posibilidad ng isang estado ay humahantong sa isang kaukulang ebolusyon ng H function.
– H-function ng rehiyon ng espasyo PERO inookupahan ng gas. Mula sa (9) makikita na W at H magkakaugnay, i.e. ang isang pagbabago sa posibilidad ng isang estado ay humahantong sa isang kaukulang ebolusyon ng H function.

Ang prinsipyo ng Boltzmann ay nagtatatag ng isang relasyon sa pagitan ng entropy S pisikal na sistema at thermodynamic na posibilidad W ang kanyang katayuan:

(nakalimbag ayon sa publikasyon: Kogan M.N. Dynamics of rarefied gas. - M .: Nauka, 1967.)
Pangkalahatang view ng CUBE:

nasaan ang puwersa ng katawan dahil sa pagkakaroon ng iba't ibang larangan (gravitational, electric, magnetic) na kumikilos sa molekula; J ay ang integral ng banggaan. Ito ang terminong ito ng Boltzmann equation na isinasaalang-alang ang mga banggaan ng mga molekula sa isa't isa at ang mga kaukulang pagbabago sa mga bilis ng nakikipag-ugnayan na mga particle. Ang integral ng banggaan ay isang limang-dimensional na integral at may sumusunod na istraktura:

Ang equation (12) na may integral (13) ay nakuha para sa banggaan ng mga molecule, kung saan walang tangential forces, i.e. ang mga nagbabanggaan na particle ay ipinapalagay na perpektong makinis.
Sa proseso ng pakikipag-ugnayan, ang panloob na enerhiya ng mga molekula ay hindi nagbabago, i.e. ipinapalagay na ang mga molekulang ito ay perpektong nababanat. Dalawang grupo ng mga molekula ang isinasaalang-alang na may mga tulin at , ayon sa pagkakabanggit, bago ang banggaan (pagbangga) sa isa't isa (Larawan 1), at pagkatapos ng banggaan, ayon sa pagkakabanggit, mga bilis at . Ang pagkakaiba sa mga bilis ay tinatawag na kamag-anak na bilis, i.e. . Ito ay malinaw na para sa isang makinis na nababanat na banggaan. Mga function ng pamamahagi f 1 ", f", f 1 ,f ilarawan ang mga molekula ng kaukulang mga grupo pagkatapos at bago ang banggaan, i.e. ![]() ;
; ![]() ;
; ![]() ;
; ![]() .
.

kanin. 1. Pagbangga ng dalawang molekula.
Kasama sa equation (13) ang dalawang parameter na nagpapakilala sa lokasyon ng nagbabanggaan na mga molekula na may kaugnayan sa bawat isa: b at ε; b- distansya ng pagpuntirya, i.e. ang pinakamaliit na distansya na lalapitan ng mga molekula sa kawalan ng pakikipag-ugnayan (Larawan 2); Ang ε ay tinatawag na angular collision parameter (Larawan 3). Tapos na ang pagsasama b mula 0 hanggang ¥ at mula 0 hanggang 2p (dalawang panlabas na integral sa (12)) ay sumasaklaw sa buong eroplano ng pakikipag-ugnayan ng puwersa patayo sa vector

kanin. 2. Trajectory ng paggalaw ng mga molekula.

kanin. 3. Pagsasaalang-alang ng interaksyon ng mga molekula sa isang cylindrical coordinate system: z, b, ε
Ang Boltzmann kinetic equation ay hinango sa ilalim ng mga sumusunod na pagpapalagay at pagpapalagay.
1. Ito ay pinaniniwalaan na ang pangunahing banggaan ng dalawang molekula ay nangyayari, i.e. ang papel ng mga banggaan ng tatlo o higit pang mga molekula nang sabay-sabay ay hindi gaanong mahalaga. Ginagawang posible ng pagpapalagay na ito na gamitin ang function ng pamamahagi ng isang partikulo para sa pagsusuri, na tinawag lamang na function ng pamamahagi sa itaas. Ang pagsasaalang-alang sa banggaan ng tatlong molekula ay humahantong sa pangangailangang gumamit ng dalawang-particle distribution function sa pag-aaral. Alinsunod dito, ang pagsusuri ay nagiging mas kumplikado.
2. Pagpapalagay ng molekular na kaguluhan. Ito ay ipinahayag sa katotohanan na ang mga probabilidad ng pag-detect ng particle 1 sa phase point at particle 2 sa phase point ay independiyente sa bawat isa.
3. Pantay na posibleng banggaan ng mga molecule na may anumang impact distance, i.e. ang distribution function ay hindi nagbabago sa diameter ng pakikipag-ugnayan. Dapat tandaan na ang nasuri na elemento ay dapat na maliit upang f sa loob ng elementong ito ay hindi nagbabago, ngunit sa parehong oras, upang ang kamag-anak na pagbabagu-bago ~ ay hindi malaki. Ang mga potensyal na pakikipag-ugnayan na ginamit sa pagkalkula ng integral ng banggaan ay spherically simetriko, i.e. ![]() .
.
Pamamahagi ng Maxwell-Boltzmann
Ang estado ng balanse ng gas ay inilalarawan ng ganap na pamamahagi ng Maxwellian, na siyang eksaktong solusyon ng Boltzmann kinetic equation:

kung saan ang m ay ang masa ng molekula, kg.
Ang pangkalahatang lokal na pamamahagi ng Maxwellian ay tinatawag na pamamahagi ng Maxwell-Boltzmann:

sa kaso kapag ang gas ay gumagalaw bilang isang buo na may bilis at ang mga variable n , T ay nakasalalay sa coordinate
at oras t.
Sa gravitational field ng Earth, ang eksaktong solusyon ng Boltzmann equation ay nagpapakita ng:
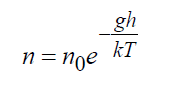
saan n 0 = density malapit sa ibabaw ng Earth, 1/m 3 ; g- acceleration ng gravity, m / s 2; h ay ang taas, m. Ang formula (16) ay ang eksaktong solusyon ng Boltzmann kinetic equation alinman sa isang walang katapusang espasyo o sa pagkakaroon ng mga hangganan na hindi lumalabag sa distribusyon na ito, habang ang temperatura ay dapat ding manatiling pare-pareho.
Ang pahinang ito ay dinisenyo ni Puzina Yu.Yu. sa suporta ng Russian Foundation para sa Basic Research - proyekto No. 08-08-00638.
Ipinanganak noong 1844 sa Vienna. Si Boltzmann ay isang pioneer at tuklas sa agham. Ang kanyang mga gawa at pananaliksik ay madalas na hindi nauunawaan at tinanggihan ng lipunan. Gayunpaman, sa karagdagang pag-unlad ng pisika, ang kanyang mga gawa ay kinilala at pagkatapos ay nai-publish.
Ang mga pang-agham na interes ng siyentipiko ay sumasaklaw sa mga pangunahing lugar tulad ng pisika at matematika. Mula 1867 nagtrabaho siya bilang isang guro sa ilang mas mataas na institusyong pang-edukasyon. Sa kanyang pananaliksik, itinatag niya na ito ay dahil sa magulong epekto ng mga molekula sa mga dingding ng sisidlan kung saan sila matatagpuan, habang ang temperatura ay direktang nakasalalay sa bilis ng mga particle (mga molekula), sa madaling salita, sa kanila. Samakatuwid, ang mas mabilis na paggalaw ng mga particle na ito, mas mataas ang temperatura. Ang Boltzmann constant ay ipinangalan sa sikat na Austrian scientist. Siya ang gumawa ng napakahalagang kontribusyon sa pag-unlad ng static na pisika.
Ang pisikal na kahulugan ng patuloy na halaga na ito
Tinutukoy ng pare-pareho ng Boltzmann ang kaugnayan sa pagitan ng mga bagay tulad ng temperatura at enerhiya. Sa static na mechanics, ito ay gumaganap ng isang pangunahing pangunahing papel. Ang Boltzmann constant ay katumbas ng k=1.3806505(24)*10 -23 J/K. Ang mga numero sa panaklong ay nagpapahiwatig ng pinahihintulutang error sa halaga ng halaga na nauugnay sa mga huling digit. Ito ay nagkakahalaga ng noting na ang Boltzmann constant ay maaari ding makuha mula sa iba pang mga pisikal na constants. Gayunpaman, ang mga kalkulasyong ito ay medyo kumplikado at mahirap gawin. Nangangailangan sila ng malalim na kaalaman hindi lamang sa larangan ng pisika, kundi pati na rin
Ang mga butterflies, siyempre, ay walang alam tungkol sa mga ahas. Ngunit alam ng mga ibon na nanghuhuli ng mga paru-paro ang tungkol sa kanila. Ang mga ibon na hindi nakikilala ang mga ahas ay mas malamang na...
Ang isang oktaba ay ang pagitan sa pagitan ng dalawang pinakamalapit na tunog ng parehong pangalan: gawin at gawin, muli at muli, atbp. Mula sa punto ng view ng pisika, ang "pagkamag-anak" ng mga ito ...
Noong 27 B.C. e. Ang Romanong emperador na si Octavian ay tumanggap ng titulong Augustus, na sa Latin ay nangangahulugang "sagrado" (bilang parangal sa parehong pigura, sa pamamagitan ng paraan, ...
Isang tanyag na biro: "Ang NASA ay gumugol ng ilang milyong dolyar upang bumuo ng isang espesyal na panulat na maaaring sumulat sa kalawakan....
Humigit-kumulang 10 milyong organiko (iyon ay, batay sa carbon) at halos 100 libong mga inorganikong molekula lamang ang kilala. At saka...
Hindi tulad ng ordinaryong salamin, ang quartz glass ay nagpapadala ng ultraviolet light. Sa mga quartz lamp, ang pinagmumulan ng ultraviolet radiation ay isang gas discharge sa mercury vapor. Siya...
Sa malaking pagkakaiba ng temperatura sa loob ng ulap, umusbong ang malalakas na updraft. Salamat sa kanila, ang mga patak ay maaaring manatili sa hangin sa loob ng mahabang panahon at ...
